
| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
分析 同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为$\frac{30+2}{2}$=16,而SO2的相对分子质量为64,则相同体积SO2的与NO和H2的混合气体的质量为4:1,以此解答该题.
解答 解:同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为$\frac{30+2}{2}$=16,而SO2的相对分子质量为64,
称量物品质量时,砝码应放在天平的右盘,
设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=$\frac{Q}{16}$,
当充满SO2气体时,气体的质量为:m=64n=64×$\frac{Q}{16}$=4Q,容器的总质量为M+4Q,
故选C.
点评 本题考查阿伏加德罗定律及推论,题目难度中等,做题时先计算混合气体的平均相对分子质量,再与SO2做比较进行计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )
在一定条件下,某可逆反应aA(g)+bB(s)?cC(g)达到平衡后,A的转化率a(A)与温度(T)、压强(p)的关系如图所示,根据图象,下列判断正确的是( )| A. | a+b<c | |
| B. | 若T2>T1,则该反应在高温下易自发进行 | |
| C. | △H>0 | |
| D. | 若T2<T1,则该反应一定不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:| 元素 | A | B | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
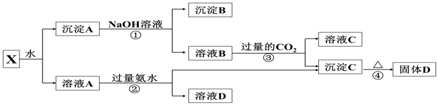
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②③④ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com