
| A | B | C | D | |
| 两极材料 | Zn片、石墨 | Zn片、Cu片 | Cu片、Ag片 | Fe片、Cu片 |
| 插入溶液 | CuSO4溶液 | 无水酒精 | AgNO3溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原电池的形成条件来判断.原电池的形成条件:
1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;
3、电极均插入电解质溶液中;
3、两极相互连接(或接触);
4、能自发的发生氧化还原反应.
解答 解:A、锌是活泼金属,石墨能导电,锌和硫酸铜能自发的发生氧化还原反应,所以能形成原电池,故A不符合;
B、两金属的活泼性不同,但无水酒精是非电解质不能导电,负极不能和电解质溶液发生氧化还原反应,所以不能形成原电池,故B符合;
C、两金属的活泼性不同,且铜片能自发的与硝酸银发生氧化还原反应,所以能形成原电池,故C不符合;
D、Fe片、Cu片,铁做负极,能自发的和稀盐酸溶液发生氧化还原反应,所以能形成原电池,故D不符合;
故选B.
点评 本题考查了原电池的形成条件,难度不大,学生应学会根据原电池的形成条件来解答即可.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组针对化学能转变为其他形式的能量,进行如下实验:
某学习小组针对化学能转变为其他形式的能量,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ⅰ | A、B、C、D、E、F、G七种短周期元素的原子序数依次增大 |
| Ⅱ | A和E同主族,B和F同主族,D和G同主族 |
| Ⅲ | A原子核内只有质子没有中子,B原子最外层电子数是电子层数的2倍 |
| Ⅳ | D和F以原子个数比为2:1组成的物质X是光导纤维的主要成分 |
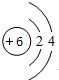 ,物质X的化学式为SiO2
,物质X的化学式为SiO2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com