
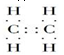 ,B的结构简式
,B的结构简式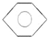 或
或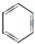 ;
;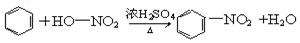 ;
;分析 A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,则原子个数之比为1:1,符合CnH2n-6,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯,以此来解答.
解答 解:(1)由以上分析可知A为乙烯,电子式为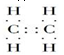 ,B为苯,结构简式为:
,B为苯,结构简式为: 或
或  ,
,
故答案为: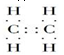 ;
; 或
或  ;
;
(2)A相邻的同系物C为CH2=CHCH3,使溴的四氯化碳溶液褪色发生加成反应,该反应为:CH2=CHCH3+Br2→CH2BrCHBrCH3,
故答案为:CH2=CHCH3+Br2→CH2BrCHBrCH3;
(3)在浓硫酸作用下,浓硝酸与苯发生取代反应生成硝基苯,方程式为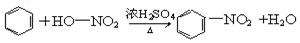 ,
,
故答案为: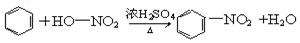 ;
;
(4)设A、B的质量都为m,由CxHy消耗x+$\frac{y}{4}$氧气,可知等质量的A、B完全燃烧时消耗O2的物质的量分别为$\frac{3m}{28}$mol和$\frac{15m}{156}$mol,所以等质量的A、B完全燃烧时消耗O2的物质的量A>B,
故答案为:A>B.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,明确A为乙烯B为苯,并熟悉乙烯与苯的化学性质即可解答,注意等质量的乙烯与苯中H的质量分数越大消耗氧气越大,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| A. | 有气体参加的化学反应,增大压强,可使单位体积内活化分子百分数增加,因而反应速率增大 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞不一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数增加,从而加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钴酞菁”分子分散在水中所形成的分散系具有丁达尔效应 | |
| B. | “钴酞菁”分子能透过半透膜 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | “钴酞菁”分子分散在水中所形成的分散系显电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2 | |
| B. | C2H4(g)+H2(g)═C2H6(g)△H3 C3H6(g)+H2(g)═C3H8(g)△H4 | |
| C. | S(s)+O2(g)═SO2(g)△H5 S(g)+O2(g)═SO2(g)△H6 | |
| D. | 2H2O(l)═2H2(g)+O2(g)△H7 2H2(g)+O2(g)═2H2O(l)△H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NH3 | B. | CO2 | C. | NaOH | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管润洗后的溶液从上口倒出 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在浓盐酸中,然后再用水稀释到所需的浓度 | |
| C. | 用铁片和稀硫酸反应制取氢气时,可改用98%的浓硫酸加快生成H2的速率 | |
| D. | 中和热的测定需要使用两个温度计分别测定开始和终点的溶液温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝土矿溶于NaOH溶液中 | B. | 偏铝酸钠溶液的酸化 | ||
| C. | 灼烧氢氧化钠固体 | D. | 电解熔融的氧化铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com