
分析 (1)n(AlCl3)=0.2mol,根据铝原子守恒计算氯化铝完全转化为氢氧化铝的质量;
(2)n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol<0.2mol,所以该反应过程中可能有两种情况,一种是氢氧化钠不足量,一种是氢氧化钠过量,据此计算氢氧化钠溶液的物质的量浓度.
解答 解:(1)n(AlCl3)=0.2mol,根据铝原子守恒n(AlCl3)=n[Al(OH)3]=0.2mol,m(AlCl3)=0.2mol×78g/mol=15.6g,故答案为:15.6g;
(2)n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol<0.2mol,所以该反应过程中可能有两种情况,一种是氢氧化钠不足量,一种是氢氧化钠过量,
当氢氧化钠不足量时,设氢氧化钠的物质的量浓度为xmol/L,
AlCl3+3NaOH═Al(OH)3↓+3NaCl,
3 1
0.1xmol 0.1mol
$\frac{3}{0.1xmol}=\frac{1}{0.1mol}$,x=3;
当氢氧化钠过量时,氯化铝转化为Al(OH)30.1mol,转化为NaAlO20.1mol,
设氢氧化钠的物质的量浓度是ymol/L,
AlCl3+3NaOH═Al(OH)3↓+3NaCl
3 1
0.3mol 0.1mol
AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
4 1
0.4mol 0.1mol
所以n(NaOH)=0.3mol+0.4mol=0.7mol,
则c(NaOH)=$\frac{0.7mol}{0.1L}$=7mol/L,
故答案为:3mol/L或7mol/L.
点评 本题考查了铝的有关计算,结合原子守恒来分析解答,注意(2)中要先判断氢氧化钠溶液是否过量,再分情况讨论,难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
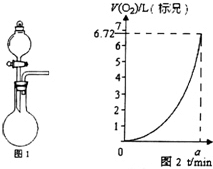 某同学探究KMnO4溶液和H2O2的反应.
某同学探究KMnO4溶液和H2O2的反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,活化分子的百分数不一定增大,但是化学反应速率一定增大 | |
| B. | 在化学反应前后催化剂的化学性质不变,但是由于参与化学反应导致质量减小 | |
| C. | 使用正催化剂,能降低化学反应的活化能,增大活化分子的百分数,化学反应速率一定增大 | |
| D. | 活化分子发生碰撞即可发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷原子结构示意图 | |
| B. | 水分子的电子式 | |
| C. |  酸碱中和滴定 | |
| D. |  生产原料甲醛与氨的 物质的量之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3用来制造耐高温的实验仪器 | |
| B. | Fe2O3常用作油漆和涂料 | |
| C. | 过氧化钠可以用作供氧剂、漂白剂等 | |
| D. | 熟石灰常直接用来治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中逐滴加入氨水,产生白色沉淀后消失 | |
| B. | 向Na2SiO3溶液中逐滴加入稀盐酸,产生白色胶状沉淀 | |
| C. | 钠与氧气在加热条件下反应,生成白色固体 | |
| D. | 将砂纸打磨过的铝箔加热至熔化,熔化的铝以小液滴的形式滴落下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
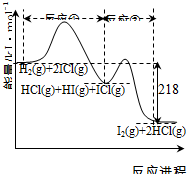
| A. | 反应①、反应②均为放热反应 | |
| B. | 反应①、反应②均为氧化还原反应 | |
| C. | 反应①比反应②的速率慢,与相应正反应的活化能无关 | |
| D. | 反应①、反应②的焓变之和为△H=-218kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠暴露在空气中,表面变暗,生成白色的氧化钠固体 | |
| B. | 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量的热,产生白色粉末 | |
| C. | 用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热 | |
| D. | 用坩埚钳夹住一小块铝箔,在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com