
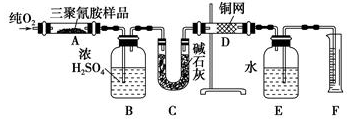
分析 氧气和三聚氰胺在A中加热条件下反应生成二氧化碳、水和氮气,B用于吸收水,C用于吸收二氧化碳,D用于吸收过量的氧气,然后用排水法测量氮气的体积,求出C、H、N三种元素的质量,确定是否有O,求出实验式,根据实验式和相对分子质量,求出分子式,以此解答该题.
解答 解:(1)由以上分析可知E装置的作用是用来排水,以测定氮气的体积,故答案为:用来排水,以测定氮气的体积;
(2)三聚氰胺的氧化以及铜与氧气的反应需要在加热的条件下进行,故答案为:AD;
(3)铜在加热条件下可与氧气反应,则D的作用为吸收未反应的氧气,故答案为:吸收未反应的氧气;
(4)用排水法测量氮气的体积,在读数时应保证E的压强与大气压相等,则量筒内的液面与广口瓶内的液面相平,且保证视线与凹液面最低处相切,
故答案为:量筒内的液面与广口瓶内的液面相平;视线与凹液面最低处相切;
(5)三聚氰胺的相对分子质量为126.取1.26g三聚氰胺样品,n=放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54g,则n(H2O)=$\frac{0.54g}{18g/mol}$=0.3mol,n(H)=0.6mol,C增重1.32g,n(CO2)=$\frac{1.32g}{44g/mol}$=0.03mol,排入F中水的体积为672mL(可按标准状况计算),则n(N2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,n(N)=0.06mol,
且m(H)+m(C)+m(N)=0.6mol×1g/mol+0.03mol×12g/mol+0.06mol×14g/mol=1.26g,则有机物不含O元素,
N(C):N(H):N(N)=0.3mol:0.6mol:0.6mol=1:2:2,所以实验式为CN2H2,
因三聚氰胺晶体的实验式为CN2H2,设分子式为(CN2H2)n,而三聚氰胺的相对分子质量为126,则42n=126,n=3,
所以分子式为C3N6H6,
故答案为:C3N6H6.
点评 本题考查有机物的分子式的测定,为高频考点,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确反应原理为解答本题的关键,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
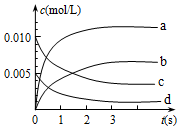 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1 mol•L-1盐酸和1L mol•L-1硫酸分别与1 L2 mol•L-1NaOH溶液反应速率相同 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1,其含义是时间为1s时,某物质的浓度是0.8mol•L-1 | |
| C. | 0.1 mol•L-1硝酸与相同形状和大小的大理石反应的速率相同 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,苯酚可以和甲醛发生加聚反应生成酚醛树脂 | |
| B. | 聚丙烯酸钠属于功能高分子材料,具有较强的吸水性 | |
| C. | 酶是具有催化作用的蛋白质,在光、热、酸、碱、重金属离子、乙醇等作用下会失去活性 | |
| D. | 淀粉溶液、肥皂水都是胶体,都有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com