
| 反应物 | 起始温度t1℃ | 终止温度t2℃ |
| H2SO4+NaOH | 20 | 33.6 |
| H2SO4+NH3•H2O | 20 | 32.6 |
| A. | +2.1 | B. | +4.2 | ||
| C. | +52.7 | D. | 缺少数据无法计算 |
分析 根据反应的焓变公式△H=-$\frac{cm△T}{n}$分别计算两个反应的焓变,根据盖斯定律计算反应NH3•H2O?NH4++OH-的焓变,以此解答该题.
解答 解:根据反应的焓变公式△H=-$\frac{cm△T}{n}$,
H2SO4、NaOH反应:①2H+(aq)+2OH-(aq)=2H2O(l)的焓变为-$\frac{4.184×100×1[(33.6-20)+273]}{0.05}$×0.001kJ/mol=-2398.3kJ/mol,
H2SO4、NH3•H2O反应②2H++2NH3•H2O(aq)=2NH4+(aq)+2H2O(l)的焓变为-$\frac{4.184×100×1[(32.6-20)+273]}{0.05}$×0.001kJ/mol=-2389.9kJ/mol,
②-①得到反应:NH3•H2O(aq)?NH4+(aq)+OH-(aq)的焓变=[2389.9kJ/mol+2398.3kJ/mol]×$\frac{1}{2}$=+4.2kJ/mol.
故选B.
点评 本题考查反应热与焓变,为高频考点,侧重考查学生的分析能力和计算能力,主要把握焓变的计算以及盖斯定律应用,属于综合知识的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
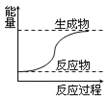
| A. | 图所示的反应为放热反应 | |
| B. | 图可表示石灰石高温分解 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<b | B. | a=b | C. | a>b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17 | B. | 25 | C. | 27 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
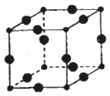 Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)
Cu3N具有良好的电学和光学性能,其晶胞结构如图,Cu+半径为apm,N3-半径为bpm,Cu+和N3-都是紧密接触的刚性小球,则N3-的配位数为6,Cu3N的密度为$\frac{1.03×1{0}^{32}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(化为最简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com