
| A. | 铁与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,则单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 过程的自发性只能用于判断其方向性,不能确定其是否一定会发生和发生的速率 | |
| D. | 中和反应放热说明中和反应前后能量不守恒 |
分析 A.加入硝酸钠,生成NO气体,不生成氢气;
B.加入反应物,单位体积内活化分子百分数不变;
C.过程的自发性只能用于判断过程的方向性,过程能不能发生还与条件有关;
D.中和反应遵循能量守恒.
解答 解:A.硝酸根离子在酸性条件下具有强氧化性,加入硝酸钠,生成NO气体,不生成氢气,故A错误;
B.加入反应物,单位体积内活化分子百分数不变,但浓度增大,化学反应速率增大,故B错误;
C.过程的自发性只能用于判断过程的方向性,过程能不能发生还与条件有关,如碳在空气中的燃烧属于自发过程,但是常温下不能发生,需要加热或点燃,故C正确;
D.中和反应遵循能量守恒,为化学能转化为热能,故D错误.
故选C.
点评 本题考查化学反应速率的影响因素、自发性的判断以及化学反应与能量转换等,为高频考点,把握习题中的信息及浓度对反应速率的影响为解答的关键,注重基础知识的考查,加NaNO3固体为解答的易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
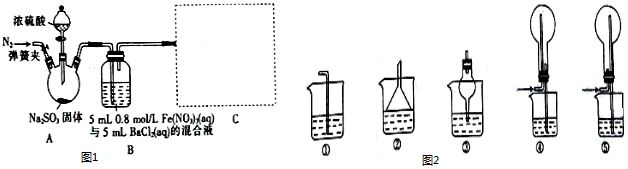
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
| B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
| C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液由红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
| D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
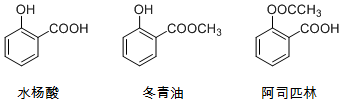
| A. | 由水杨酸制冬青油的反应是取代反应 | |
| B. | 阿司匹林的分子式为C9H8O4,水解可得水杨酸 | |
| C. | 冬青油苯环上的一氯取代物有4种 | |
| D. | 可用NaOH溶液除去冬青油中少量的水杨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaC1 | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 证明HClO 和CH3COOH的酸性强弱 | 同温下,用pH试纸定浓度均为0.1mol•L-1的NaClO溶液和CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中水加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 配制1L1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4•5H2O溶解在975g水中 | 烧杯、玻璃棒、胶头滴管、量筒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属.
已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ④②①③ | B. | ④③①② | C. | ④③②① | D. | ①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com