
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:①氢氧化钡晶体与氯化铵晶体之间的反应属于吸热反应,故正确;
②天然气的燃烧属于放热反应,故错误;
③锻烧大理石即碳酸钙分解的过程俗语吸热反应,故正确;
④盐酸与氢氧化钠溶液混合的中和反应属于放热反应,故错误;
⑤生石灰与水反应生成熟石灰的化合反应属于放热反应,故错误;
故答案为:①③.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )
天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )| A. | 氧化剂 | B. | 还原剂 | C. | 强酸 | D. | 强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| ?① | 2mL | 20 | |
| ?② | 2mL | 20 | 10滴饱和MnSO4溶液 |
| ?③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
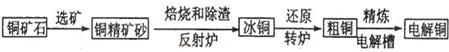
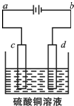
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com