
已知298 K时下列物质的溶度积(单位略)。
| CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的 和Cl-的溶液中慢慢滴入AgNO3溶液时,
和Cl-的溶液中慢慢滴入AgNO3溶液时, 先沉淀
先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是 。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式): 。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为 、 。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为 ,每个K+与 个F-配位。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:选择题
关于下列图示的说法中,正确的是
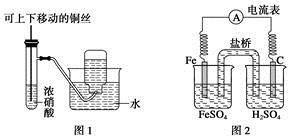
A.图1制备并收集少量NO2气体
B.图2是原电池装置,Fe电极为负极
C.图3常用于分离互不相溶的液体
D.图4可用于实验室制取和收集乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学热化学方程式的正误判断及书写(解析版) 题型:选择题
已知:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol;
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
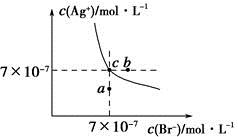
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学水的电离与溶液酸碱性(解析版) 题型:选择题
下列叙述不正确的是
A.向纯水中加入少量CH3COONa固体,促进了水的电离
B.25°C 时,pH=3的醋酸与pH=3的HCl对水的电离抑制作用相同
C.25°C时,pH=3的NH4Cl溶液中,水电离出的c(H+)是10-3mol/L
D.升高温度,纯水电离出的c(H+)增大,pH减少,显酸性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氯、溴、碘及其化合物主要性质(解析版) 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:

Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙
c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子_____________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________________________________
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氮气、氧化物及硝酸(解析版) 题型:选择题
下列说法不正确的是
A.新制氯水可使蓝色石蕊试纸先变红后褪色
B.浓硝酸在光照下发黄,说明浓硝酸不稳定
C.SO2、NO2分别与水发生的反应均为氧化还原反应
D.水泥、普通玻璃、陶瓷等都是传统的硅酸盐制品
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原反应方程式的配平及相关计算(解析版) 题型:选择题
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为
A.FeO B.Fe2O3 C.Fe3O4 D.Fe8O10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com