解答:
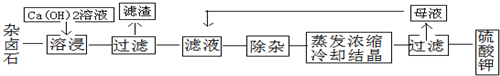
解:废铁屑中含少量氧化铝、氧化铁等,将过量废铁屑加入稀硫酸中,发生反应 Fe+H
2SO
4=FeSO
4+H
2↑、Al
2O
3+3H
2SO
4=Al
2(SO
4)
3+3H
2O、Fe
2O
3+3H
2SO
4=Fe
2(SO
4)
3+3H
2O、Fe
2(SO
4)
3+Fe=3FeSO
4,然后反应I中加入NaHCO
3并搅拌,调节溶液的pH,发生反应Al
3++3HCO
3-=Al(OH)
3↓+3CO
2↑,所以滤渣中成分是Al(OH)
3,过滤得到硫酸亚铁,向硫酸亚铁溶液中加入稀硫酸和NaNO
2,酸性条件下,NaNO
2和FeSO
4发生氧化还原反应生成铁离子、NO,将溶液蒸发浓缩、过滤得到碱式硫酸铁,
(1)根据氢氧化物沉淀需要的pH知,在pH在4.4-7.5之间将铝离子转化为Al(OH)
3沉淀,而亚铁离子不能生成沉淀,所以条件溶液的pH范围为4.4-7.5之间,
故答案为:4.4-7.5;Al
3+;
(2)酸性条件下,亚硝酸钠具有氧化性,能将亚铁离子氧化为铁离子,自身被还原生成NO,所以反应Ⅱ中加入NaNO
2的目的是氧化Fe
2+,发生反应的离子方程式为 2H
++Fe
2++NO
2-=Fe
3++NO↑+H
2O,
故答案为:Fe
2+;2H
++Fe
2++NO
2-=Fe
3++NO↑+H
2O;
(3)在实际生产中,反应Ⅱ常同时通入O
2以减少NaNO
2的用量,若参与反应的O
2有11.2L(标准状况),反应过程中提供电子相等,则相当于节约NaNO
2的物质的量=
=2mol,故答案为:2mol;
(4)碱式硫酸铁溶于水后产生的Fe(OH)
2+离子,Fe(OH)
2+可部分水解生成Fe
2(OH)
42+聚合离子,该水解反应的离子方程式为 2Fe(OH)
2++2H
2O?Fe
2(OH)
42++2H
+,故答案为:2Fe(OH)
2++2H
2O?Fe
2(OH)
42++2H
+;
(5)亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,反应过程中颜色变化明显的效果最佳,
A.溴水为橙红色,溴将亚铁离子氧化为铁离子,溶液呈黄色,颜色变化不明显,故A不选;
B.KSCN溶液和亚铁离子不反应,没有颜色变化,故B不选;
C.NaOH溶液和亚铁离子反应生成白色沉淀,铁离子和氢氧根离子反应生成红褐色沉淀,掩盖氢氧化亚铁颜色,故C不选;
D.酸性KMnO
4溶液呈紫色,亚铁离子能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,现象明显,故D选;
故选D.




 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案