
| A. | HCO3-在水溶液中的水解方程式:HCO3-+H2O?H3O++CO32- | |
| B. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| C. | AlCl3溶液和NaAlO2溶液分别加热、蒸干,得到成分相同的固体Al(OH)3 | |
| D. | NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 |
分析 A.碳酸氢根离子水解生成碳酸和氢氧根离子;
B.存在水解平衡,不能完全除去;
C.根据这两种盐水解时生成物的性质分析判断最终灼烧物质;
D.铵根离子、锌离子水解显酸性.
解答 解:A.HCO3-在水溶液中的水解方程式:HCO3-+H2O?H2CO3+OH-,故A错误;
B.存在水解平衡,不能完全除去,可加入过量KOH,过滤后再加入盐酸,故B错误;
C.加热偏铝酸钠溶液时,偏铝酸钠溶液水解生成氢氧化钠和氢氧化铝,蒸干灼烧氢氧化钠和氢氧化铝的混合物得到的物质是氢氧化钠和氧化铝;加热氯化铝溶液时,氯化铝水解生成氯化氢和氢氧化铝,盐酸易挥发,导致铝离子水解程度加深,蒸干灼烧时,氢氧化铝分解生成氧化铝,所以两种盐溶液得到的物质不都是氧化铝,故C错误;
D.NH4Cl与ZnCl2溶液水解显酸性,能与铁锈反应,所以可作焊接金属中的除锈剂,与盐的水解有关,故D正确;
故选:D.
点评 本题考查了盐类水解的应用,明确盐类水解的实质及应用是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要完成实验需称取10.6gNa2CO3﹒10H2O晶体 | |
| B. | 本实验需用到的仪器是天平、药匙、玻璃棒、烧杯、100mL容量瓶 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
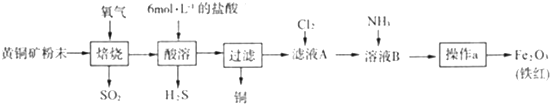
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
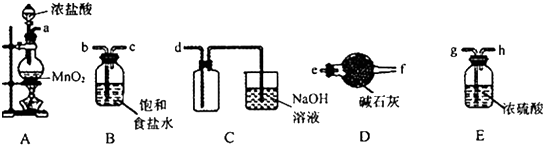
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com