
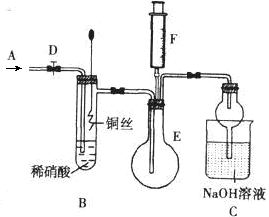


科目:高中化学 来源:不详 题型:实验题
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
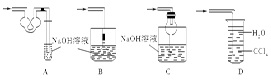
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体 |
C.NH5的电子式为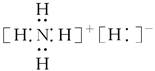 |
| D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入适量的Na2CO3溶液 |
| B.通入溴蒸气 |
| C.加入适量的NaOH溶液 |
| D.加入适量的NaBr溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B.加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C.加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D.加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |
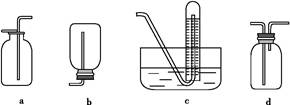
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸和稀硝酸都具有氧化性 |
| B.铜与硝酸的反应属于置换反应 |
| C.金属与HNO3反应一般不产生氢气 |
| D.可用铁或铝制品盛装浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
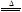 2KNO2+O2↑
2KNO2+O2↑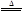 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑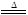 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com