
为了测定有机物A的组成和结构,称取A样品5.3 g,使其完全燃烧,将生成物先后通过过量的无水CaCl2和碱石灰,两者分别增重 4.5g 和 17.6g(设生成物完全被吸收)。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为106。
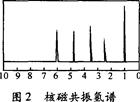
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为l:2:2:2:3,如图2所示:
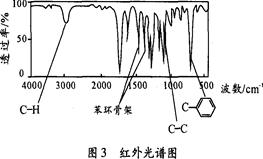
方法三:利用红外光谱仪测得A分子的红外光谱如图3所示。
回答下列问题:
(1)A的分子式为 。
(2)A的分子中含一个甲基的依据是 。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图d.A分子的红外光谱图
(3)A的结构简式为 。
(1) C8H10 (2)
bc (3) 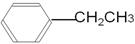
【解析】
试题分析:(1)5.3gA的物质的量是5.3g÷106g/mol=0.05mol
完全燃烧生成的H2O或CO2的质量分别是4.5g和17.g
物质的量分别是0.25mol和0.4mol
其中碳氢原子的质量之和是0.4mol×12g/mol+0.25mol×2×1g/ml=5.3g
这说明有机物A中不存在氧原子
则该有机物的最简式是C4H5
所以分子式是C8H10
(2)如果A分子中含有2个甲基,则A的核磁共振氢谱中就一定不会出现5组峰,所以根据A的化学式以及A分子的核磁共振氢谱图可知,A分子中含有1个甲基,答案选bc。
(3)根据A的核磁共振氢谱图和红外光谱图可知,A应该是乙苯,结构简式是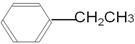 。
。
考点:考查有机物分子式及结构简式的判断
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的训练与巩固。主要是考查学生对核磁共振氢谱和红外光谱图的熟悉了解掌握程度,有利于培养学生的创新思维能力,提高学生分析问题、解决问题的能力。该题的关键是熟练记住等效氢原子的判断依据,然后灵活运用即可。


科目:高中化学 来源: 题型:阅读理解
(12分)白色固态有机酸A含碳、氢和氧元素。为了得到摩尔质量的估值,将10.0g该有机酸溶于水,加入碎冰,激烈摇荡,结果温度降至-2.5℃后迅速除去冰,测得溶液的质量为76.1g,pH值为1.4。由手册中查到,水的摩尔冰点下降常数为1.86kg?K?mol-1。然后,对该酸的准确摩尔质量作了精确测定。0.120g该酸用0.100mol/L的氢氧化钠溶液滴定,以酚酞为指标剂,当指示剂变色时,用去氢氧化钠溶液23.4mL。
5-1 得出该酸(A)的摩尔质量和结构。
液体B溶于水可以达到10%,该溶液的pH值约为4。B不易氧化,但能发生碘仿反应,产物经酸化,氧化成A。0.10gB消耗1.5g碘单质。当B和钠反应,放出氢气,生成一种金属有机化合物X,X阴离子的摩尔质量约为98g/mol。
5-2 写出碘仿反应的化学方程式及上述B与钠的反应,其中的有机物应采用结构式。
化合物C的水溶液的导电性和纯水相差无几。C碱性水解生成氨。0.120g C用热的氢氧化钠稀溶液处理,将生成的气体导入50.0cm3浓度为0.100mol/dm3的盐酸中;剩余的酸用0.100mol/dm3氢氧化钠溶液滴定,消耗10.0cm3。C酸性水解生成二氧化碳。由冰点下降得知C的摩尔质量估值在40~70g/mol之间。
5-3 写出C的结构。写出它的碱性水解及酸性水解的离子方程式。
令C在强碱催化剂存在下与酸A的乙酯反应,生成乙醇和化合物D。D的组成为37.5%(质量分数,下同)C、3.1% H和21.9% N,其余是氧。该化合物是一种酸。
5-4 写出D的结构。其酸性氢原子在何处?请在结构式中用*标出。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com