
已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 原子的最外层电子数是次外层电子数的3倍. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和. |
| E | 生产和生活中用量最大的金属. |
请根据信息回答有关问题:
(1)元素Y的核外电子排布式为 .
(2)元素X与Z可形成化合物XZ2,XZ2属于 晶体,电子式为 .
(3)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) .
(4)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点最高的是(写化学式) .
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(6)E能形成E2+和E3+两种价态的离子,检验E2+中含有 E3+的最佳试剂是 ,要除去E2+中E3+可加入 ,离子方程式为 .
| 原子结构与元素的性质;配合物的成键情况. | |
| 专题: | 元素周期律与元素周期表专题;化学键与晶体结构. |
| 分析: | X元素原子原子的L层上s电子数等于p电子数,核外电子排布为1s22s22p2,则X为C元素;Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,则Y为N元素;Z元素原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Q元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为1s22s22p63s23p5,则Q为Cl;R核电荷数是Y与Q的核电荷数之和,其核电荷数=7+17=24,则R为Cr;E是生产和生活中用量最大的金属,则E为Fe,据此解答. |
| 解答: | 解:X元素原子原子的L层上s电子数等于p电子数,核外电子排布为1s22s22p2,则X为C元素;Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,则Y为N元素;Z元素原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Q元素单质常温、常压下是气体,原子的M层上有1个未成对的p电子,原子核外电子排布为1s22s22p63s23p5,则Q为Cl;R核电荷数是Y与Q的核电荷数之和,其核电荷数=7+17=24,则R为Cr;E是生产和生活中用量最大的金属,则E为Fe, (1)Y元素原子核外的L层有3个未成对电子,核外电子排布为1s22s22p3,故答案为:1s22s22p3; (2)元素C与O可形成化合物CO2,CO2属于分子晶体,其电子式为 (3)C、N、O同周期,随原子序数增大,元素的电负性增大,故电负性O>N>C, 故答案为:O>N>C; (4)X、Z、Q元素均表现最低化合价时的三种氢化物分别为CH4、H2O、HCl中,水分子之间存在氢键,常温下为液态,另外两种为气体,故沸点最高的是,故答案为:H2O; (5)根据题意知,氯化铬(CrCl3•6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,则CrCl3•6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3•6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2•H2O, 故答案为:B; (6)检验Fe2+中含有Fe3+的最佳试剂是KSCN溶液,要除去Fe2+中Fe3+可加入Fe粉,离子方程式为 2Fe3++Fe=3Fe2+, 故答案为:KSCN溶液;Fe粉;2Fe3++Fe=3Fe2+. |
| 点评: | 本题考查结构性质位置关系应用,涉及核外电子排布、电子式、电负性、配合物、元素化合物性质等,难度中等,明确元素种类是关键,(5)中注意配合物中外界离子与配体性质区别. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某无色溶液,其中可能存在Na+、Ba2+、Al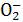 、S2-、S
、S2-、S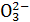 、S
、S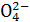 。取该溶液进行有关实验,实验结果如图所示,请回答:
。取该溶液进行有关实验,实验结果如图所示,请回答:
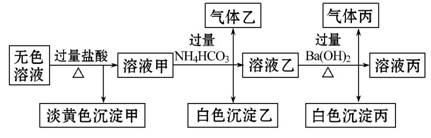
(1)沉淀甲的化学式为 。
(2)由溶液甲生成沉淀乙的离子方程式为 。
(3)沉淀丙中一定含有 ,可能含有 。
(4)综合上述信息,该溶液中肯定存在的离子有: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为短周期元素①~⑧的部分性质。( )
|
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | —2 | —3 | —1 | —3 |
下列说法正确的是
A.元素①②形成的化合物具有两性 B.元素④⑤形成的化合物是离子化合物
C.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的反应,属于同一反应类型的是( )
|
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 |
|
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色 |
|
| C. | 甲苯硝化制TNT;乙烯氧化制乙醛 |
|
| D. | 乙醇脱水制乙烯;溴乙烷消去制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
新兴的大脑营养学研究发现,大脑生长发育与不饱和脂肪酸有密切关系.从深海鱼油中提取的被称为“脑黄金”的DHA就是一种不饱和程度很高的脂肪酸,它的分子组成中有6个碳碳双键、学名二十六碳六烯酸.它的分子组成应是( )
|
| A. | C25H50COOH | B. | C25H39COOH | C. | C26H41COOH | D. | C26H47COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示进行实验,下列说法正确的是( )
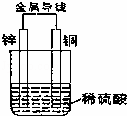
|
| A. | 铜片上冒气泡,该气体是H2,铜片是正极,该装置是原电池 |
|
| B. | 锌片质量减小,锌片是负极,发生还原反应 |
|
| C. | 电子流向:锌→导线→铜→稀硫酸→锌,形成一个闭合回路 |
|
| D. | 溶液中的阳离子移向负极,阴离子移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于现有元素周期表的说法不正确的是( )
|
| A. | 编排的总原则是按元素的核电荷数递增的顺序排列,且将电子层数相同的元素排成同一行,将最外层电子数相同的排成同一列 |
|
| B. | 一个族就是一列,一个周期就是一个横行 |
|
| C. | 指导人们在金属与非金属元素的分界线附近寻找半导体材料 |
|
| D. | 指导人们在过渡元素中寻找合适的有机反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下容积为10L的密闭容器中加入一定量的SO2、O2并发生如下反应:2SO2(g)+O2(g)⇌2SO3(g),经过10分钟测得容器中三种物质SO2、O2、SO3的物质的量分别为3mol、9mol、2mol,再经过t分钟时反应达到了平衡状态,且已知平衡状态时SO2的转化率为80%(提示:SO2的转化率是指反应掉的SO2占原来SO2总量的百分数),回答下列问题:
(1)前10分钟SO2的平均反应速率为 ,10分钟时该反应是否达到平衡状态
(填“是”、“否”、“不一定”),开始时加入容器中的O2的物质的量为 ;
(2)平衡状态时容器中O2的浓度为 ,关于t分钟的下列说法正确的是 ;
A.t肯定大于10
B.t肯定小于10
C.t一定等于10
D.t可能大于10、也可能等于或小于10
(3)改变温度化学平衡发生移动,最后重新达到新的平衡状态,在新平衡状态下测得各物质的浓度数据如下,其中合理的是 ;
A.c(SO2)=0.2mol/L,c(O2)=0.8mol/L,c(SO3)=0.3mol/L
B.c(SO2)=0.2mol/L,c(O2)=0.85mol/L,c(SO3)=0.3mol/L
C.c(SO2)=0.2mol/L,c(O2)=0.8mol/L,c(SO3)=0.4mol/L
D.c(SO2)=0.05mol/L,c(O2)=0.775mol/L,c(SO3)=0.35mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
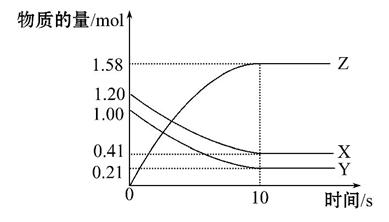
A.从反应开始到10 s时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.10 s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g)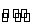 2Z(g)
2Z(g)
D.从反应开始到10 s时,平均反应速率v(X)=v(Y)=0.039 5 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com