
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H2=bkJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ·mol-1
则C的燃烧热________kJ·mol-1
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:

①反应达平衡的标志是(填字母代号)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为。
③若提高N2的转化率可采取的措施有。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大E.加入一定量的N2
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z<M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①常用于分离沸点相差较大的液体混合物 | |
| B. | 图②用于吸收尾气SO2 | |
| C. | 图③用于干燥、收集少量NH3 | |
| D. | 采用图④的操作排出碱式滴定管尖嘴处的气泡 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:实验题
冰晶石(Na3 AlF6)难溶于水,广泛应用于铝的冶炼。工业上用萤石(CaF2)为原料生产Na3 AIF6:
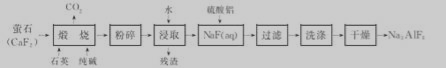
回答下列问题:
(1)Na3AIF6为助溶剂,冶炼铝的化学方程式为 。
(2)写出煅烧时总反应的化学方程式为________。
(3)煅烧后的固体在浸取前进行粉碎的目的是____,为达到相同目的,常温浸取时还可采取的措施是____。
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:____。NaF溶液呈碱性,用离子方程式表示其原因: ,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物 。
(5)97.5kg含CaF280%萤石(杂质不含氟元素)理论上可生产Na3 AIF6 kg(设生产过程中的每一步含氟物质均完全转化)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:选择题
下列根据实验现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有漂白性 |
B | C2H5OH与浓硫酸混合后加热到170℃ | 生成的气体使酸性KMnO4溶液褪色 | 反应一定生成了乙烯 |
C | 向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊 | 试纸变为蓝色 | NO3-被还原为NH3 |
D | 向NaSiO3溶液中滴加I滴酚酞试液,然后逐滴加入稀盐酸至红色褪去 | 产生胶装沉淀 | 非金属性:Cl>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
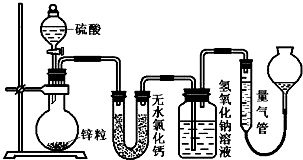
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
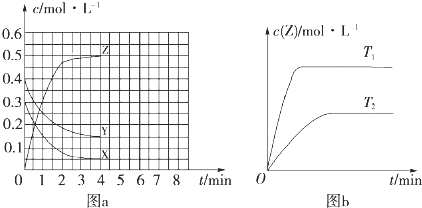
| A. | 发生反应时,各物质的反应速率大小关系为v(X)=v (Y)=2 v (Z) | |
| B. | 图a 中反应达到平衡时,Y 的转化率为37.5% | |
| C. | T0 时,该反应的平衡常数为 33.3 | |
| D. | 该反应正反应的反应热△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热到90℃ | B. | 向水中加少量Na2CO3溶液 | ||
| C. | 向水中加少量NaOH溶液 | D. | 向水中加少量FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com