
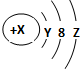
| A. | Y=2 | |
| B. | 若X=18,则Z=8 | |
| C. | 若X=17,它的最高价氧化物化学式为W2O7 | |
| D. | 若X=14,它的氢化物的化学式为H2W |
分析 A.第一电子层容纳2个电子,故Y=2;
B.W粒子可能是阴离子、阳离子或中性原子;
C.若X=17,则W为氯元素,最高价氧化物是Cl2O7;
D.若X=14,则为Si元素,氢化物的化学式为SiH4.
解答 解:A.微粒有3个电子层,第一电子层填充满电子,第一电子层容纳2个电子,故Y=2,故A正确;
B.W粒子为中性原子,若X=18,则Z=8,但W也可能是阴离子或阳离子,质子数不等于核外电子数,故B错误;
C.若X=17,则W为氯元素,最高价氧化物是Cl2O7,符合W2O7,故C正确;
D.若X=14,则为Si元素,氢化物的化学式为SiH4,不符合H2W,故D错误;
故选BD.
点评 本题考查核外电子排布规律、微粒中质子数与电子数关系、结构位置性质关系等,比较基础,注意W粒子可能是阴离子、阳离子或中性原子.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 | 0 |
| A. | b对应元素的最高价氧化物的水化物的碱性比e强 | |
| B. | d的水溶液显碱性 | |
| C. | H具有可燃性 | |
| D. | e相应的元素的单质与g微粒任何条件下都不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
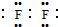 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的中子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内形成x mol的A-A键,同时形成x mol的A-B键 | |
| B. | 容器内的总压强不随时间变化,气体的密度不再随时间变化 | |
| C. | A2、AB、B2的浓度不再随时间改变 | |
| D. | 单位时间内生成x mol的A2分子,同时生成x mol的B2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成化合物BA3 | |
| B. | C、D、E形成的化合物与A、B、C形成的化合物可能发生氧化还原反应 | |
| C. | A2C2和D2C2具有完全相同类型的化学键 | |
| D. | E的最高价氧化物对应的水化物一定具有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

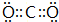 ,其中②原子的杂化方式为sp.
,其中②原子的杂化方式为sp.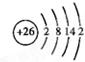 ,⑪原子的价电子排布式是4s24p3
,⑪原子的价电子排布式是4s24p3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com