
| A. | 酸性:HClO>HBrO4>HIO4 | B. | 碱性:Al(OH)3>Mg(OH)2>NaOH | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 非金属性:F>O>S |
分析 A.非金属性越强,对应最高价含氧酸的酸性越强;
B.金属性越强,对应碱的碱性越强;
C.非金属性越强,对应氢化物越稳定;
D.同周期从左向右非金属性增强,同主族从上到下非金属性减弱.
解答 解:A.非金属性Cl>Br>I,则酸性:HClO4>HBrO4>HIO4,而HClO为酸性很弱的酸,故A错误;
B.金属性Na>Mg>Al,碱性:Al(OH)3<Mg(OH)2<NaOH,故B错误;
C.非金属性Cl>S>P,对应氢化物稳定性:PH3<H2S<HCl,故C错误;
D.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:F>O>S,故D正确;
故选D.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
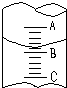 ①图表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为:C
①图表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为:C查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都具有丁达尔效应 | |
| B. | 分散质的粒子直径均在1~100nm之间 | |
| C. | 加烧碱溶液都会沉淀 | |
| D. | 前者是混合物,后者是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
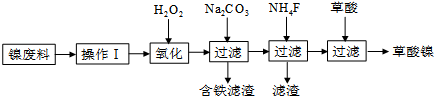
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煮沸后的溶液中没有加碱 | B. | 蔗糖尚未水解 | ||
| C. | 加热时间不够 | D. | 蔗糖水解的产物中没有葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 油脂的皂化反应生成脂肪酸和丙醇 | |
| D. | 将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com