
【题目】ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集ClO2 . 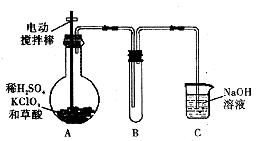
已知:①ClO2为黄绿色气体,极易溶于水,熔点﹣59C,沸点11℃,具有强氧化性.
②ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低.
③装置A中发生反应:H2C2O4+H2SO4+2KC1O3一K2SO4+2CO2 T+2ClO2+2H2O
④HClO2是强酸.
(1)A装置中电动搅拌棒的作用是 .
(2)B装置需放在冰水中,原因是 .
(3)用H2C2O4、稀硫酸和KClO3制备ClO2的最大优点是 .
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行下列实验:步骤1:准确量取V1mL ClO2溶液加入到锥形瓶中.,
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol.L﹣1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
(已知2ClO2+8H++10I﹣=2Cl﹣+5I2+4H2O,2S2O32﹣+I2=2I﹣+S4O62﹣)
①配制100mL cmol﹣L﹣lNa2S203标准溶液时,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和 .
②原溶液中ClO2的含量为g/L(用含字母的代数式表示).
(5)工业上生产ClO2和NaCIO2的工艺流程如图:
①反应器I中发生反应的化学方程式为 .
②反应器Ⅱ中发生反应的离子方程式为 .
③在碱性溶液中NaClO2比较稳定,所以反应器Ⅱ中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 .
【答案】
(1)反应时搅拌,增大反应物的接触面积,加快反应速率
(2)使ClO2 冷凝,便于分离收集
(3)反应生成二氧化碳,可以稀释ClO2 , 大大降低了爆炸的可能性
(4)100mL容量瓶;![]()
(5)3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O;连续测定反应器Ⅱ内溶液的pH
【解析】解:(1)A装置中电动搅拌棒,增大反应物的接触面积,加快反应速率,所以答案是:反应时搅拌,增大反应物的接触面积,加快反应速率;(2)ClO2是一种黄绿色、有刺激性气味的气体,熔点:﹣59.0℃,沸点:11.0℃,B装置要放置在冰水中,使ClO2 冷凝,便于收集,所以答案是:使ClO2 冷凝,便于收集;(3)信息②中ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低,而反应生成二氧化碳,可以稀释ClO2 , 大大降低了爆炸的可能性,所以答案是:反应生成二氧化碳,可以稀释ClO2 , 大大降低了爆炸的可能性;(4)①称量后在烧杯中溶解,并用玻璃棒搅拌,移入100mL容量瓶中,加水至距离容量瓶刻度线1﹣2cm处改用胶头滴管定容,所以答案是:100mL容量瓶;②由反应可得关系式:2ClO2~5I2~10S2O32﹣ , 可知V1mL×c(ClO2):V2mL×c(Na2S2O3)=2:10,则V1mL×c(ClO2):V2mL×c mol.L﹣1 , 故c(ClO2)= ![]() mol/L,则其含量为
mol/L,则其含量为 ![]() mol/L×67.5g/mol=
mol/L×67.5g/mol= ![]() g/L,所以答案是:
g/L,所以答案是: ![]() g/L;(5)①由流程图可知,反应器I中浓硫酸与氯酸钠反应生成ClO2、NaClO2、硫酸氢钠,反应方程式为:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O,所以答案是:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;②反应器Ⅱ中是ClO2、NaOH、SO2反应生成NaClO2 , 根据电子转移守恒,SO2被氧化为硫酸钠,溶液离子方程式为:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O,所以答案是:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O;③HClO2是强酸,NaClO2溶液呈中性,连续测定反应器Ⅱ内溶液的pH,可以判断NaOH是否过量,所以答案是:连续测定反应器Ⅱ内溶液的pH.
g/L;(5)①由流程图可知,反应器I中浓硫酸与氯酸钠反应生成ClO2、NaClO2、硫酸氢钠,反应方程式为:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O,所以答案是:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;②反应器Ⅱ中是ClO2、NaOH、SO2反应生成NaClO2 , 根据电子转移守恒,SO2被氧化为硫酸钠,溶液离子方程式为:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O,所以答案是:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O;③HClO2是强酸,NaClO2溶液呈中性,连续测定反应器Ⅱ内溶液的pH,可以判断NaOH是否过量,所以答案是:连续测定反应器Ⅱ内溶液的pH.


科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
(1)已知:CO(g)+H2O(g)H2(g)+CO2(g)△H=﹣41kJmol﹣1C(s)+2H2(g)CH4(g)△H=﹣73kJmol﹣1
2CO(g)C(s)+CO2(g)△H=﹣171kJmol﹣1
工业上可用煤制天然气,生产过程中有多种途径生成CH4 . 写出CO与H2反应生成CH4和H2O的热化学方程式 .
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 .
(3)用天然气制取H2的原理为:CO2(g)+CH4(g)2CO(g)+2H2(g).在密闭容器中通入物质的量浓度均为0.1molL﹣1的CH4与CO2 , 在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)v(逆)(填“大于”、“小于”或“等于”).求Y点对应温度下的该反应的平衡常数K= . (计算结果保留两位有效数字)
(4)以二氧化钛表面覆盖CuAl2O4 为催化剂,可以将CH4和CO2直接转化成乙酸.①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是 .
②为了提高该反应中CH4的转化率,可以采取的措施是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L HF中含HF分子数目为NA
B.60g石英晶体中含有的Si﹣O键数目为2NA
C.标准状况下,11.2 L Cl2通人足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA
D.1 L 0.1 mol/L的NaHCO3溶液中HCO ![]() 和CO
和CO ![]() 离子数之和为0.1 NA
离子数之和为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )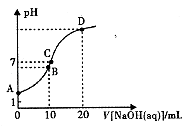
A.A点溶液中加入少量水: ![]() 增大
增大
B.B点:c( HA ﹣)>c(H+)>c(A2-)>c(H2A)
C.C点:c(Na+)=c(HA﹣)+2c( A2﹣)
D.水电离出来的c(OH﹣):B点>D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X、Y分别是地壳中含量最高的金属和非金属元素的单质,D、E、F为气体,X在酸性或碱性溶液中均可与NO3-发生氧化还原反应,气体D和G反应可生成盐,气体D和A溶液反应生成白色沉淀,气体E和F在NaOH溶液中按1:1反应钠盐M,各物质转化关系如下:

请回答下列问题:
(1)M的化学式__________。
(2)请写出D的溶液与A溶液反应的离子方程式:___________
(3)写出X在碱性条件下与NO3-反应的离子方程式:_____________
(4)标况下,若E,F的混合气体共48mL,恰好被10mL菜浓度的NaOH溶液吸收,则该NaOH溶液浓度为______mol,若反应后所得溶液中M和N的浓度之比为7:1,则原来气体中E与F的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中通常加入的是KIO3 , 该物质在酸性条件下表现出较强的氧化性,可以和碘化物、亚硫酸盐等还原性物质发生反应.
(1)写出KIO3与KI在稀硫酸介质中发生反应的离子方程式
(2)为测定菜加碘盐中碘元素的含量,某学生甲设计了如下实验: A.准确称取w g食盐,使其完全溶解在适量的蒸馏水中;
B.用稀硫酸酸化所得溶液,加入过量的KI溶液,使其充分反应;
C.以为指示剂,逐滴加入物质的量浓度为2.0×10﹣3mol/L的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为 , 则该加碘盐样品中碘元素的含量为mg/Kg(用含w的代数式表示).
(已知:I2+2S2O32﹣═2I﹣+S4O62﹣)
(3)某学生乙又进行了下列实验: A.准确称取1.0g纯净的NaCl,加3mL蒸馏水配成溶液,溶液为无色;
B.滴入5滴指示剂和1mL 0.lmol/L KI溶液,充分振荡,溶液不变化;
C.继续滴加l滴1mol/L的硫酸溶液,充分振荡,溶液变蓝色
推测实验中产生蓝色现象的原因,用离子方程式表示
根据学生乙的实验结果,请对学生甲的实验结果进行分(偏大、偏小、正确),其原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下装置可用来制取纯净干燥的氯气,根据装置回答下列问题:

(1)实验中饱和食盐水的作用:_________________。
(2)浓硫酸的作用:______________________。
(3)若用干燥管干燥氯气,则干燥管可装入的药品是:_________________。
(4)NaOH溶液的作用:_________________。发生的离子反应为_________________________
(5)上图中收集氯气的方法叫做_____________________。
(6)此实验中制取氯气的离子方程式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
(1)Na3N的电子式______________________________________________。
(2)Na3N与盐酸反应____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱. 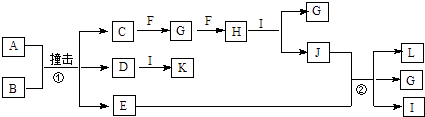
(1)F的化学式为 .
(2)K的电子式为 .
(3)写出反应①的化学方程式:
(4)写出反应②的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com