
【题目】阿伏加德罗常数值为NA,下列说法中正确的是
A. 一定条件下3.2gSO2与足量O2反应转移电子数为0.1NA
B. 2.9g异丁烷和正丁烷混合物含有C-H键数目为0.5NA
C. 50mL12mol/L浓盐酸与足量MnO2共热转移电子数0.3NA
D. 标准状况下,3.36L三氯甲烷中含有氯原子0.45NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I、Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂。已知K2FeO4在Fe3+和Fe(OH)3催化下会分解,在酸性或弱碱性能与水反应生成Fe(OH)3和O2。生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O
(1)该反应中氧化剂是______________(写电子式)
(2)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_____________________(回答一条即可)。
(3)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是__________________________________________。
②原样品中高铁酸钾的质量分数为______________。
II、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/moL ①
C(s)+O2(g)=CO2(g) △H=–393.5kJ/moL ②
2C(s)+O2(g)=2CO(g) △H=–221.0kJ/moL ③
(4)某反应的平衡常数表达式![]() ,请写出此反应的热化学方程式:__。
,请写出此反应的热化学方程式:__。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是___________(填序号)
a.容器中的压强不变
b.2v正(CO)= v逆(N2)
c.气体的平均相对分子质量保持34.2不变
d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO3(g) ![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
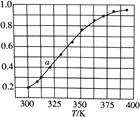
图中a点对应温度下,已知SO3的起始压强为P0kPa,该温度下反应的平衡常数KP=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中按![]() =1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
=1加入SO2和SO3,平衡将___________(填“向正反应方向移动”,“向逆反应方向移动”,“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室需要配制0.1 mol·L-1NaOH溶液500mL。
(1)根据计算用托盘天平称取的质量为__________g。在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
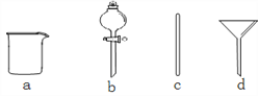
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)下面操作造成所配NaOH溶液浓度偏高的是_____。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
II.向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再向所得溶液中滴加0.1 mol/L盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
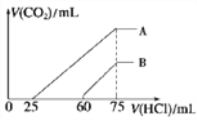
(4)①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是________mL(标准状况)。
②B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氯丙嗪也叫冬眠灵,是第一个抗精神病药,开创了药物治疗精神疾病的历史,某研究小组利用下列途径合成盐酸氯丙嗪。

已知: 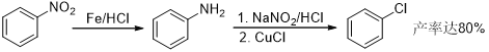
请回答:
(1) B中含有官能团名称为__________________;
(2) 下列说法不正确的是____________;
A. 化合物B可以发生加成反应
B. 化合物D在一定条件下既可与酸反应,又可以与碱反应
C. 合成路线中属于取代反应的为(1) (3) (4) (6)
D. 反应(7)是为了提高氯丙嗪的水溶性
(3) 写出E→F的化学反应方程式________________________________________________。
(4) 该研究小组在实验中发现,苯环上直接用Cl2取代的产率一般不到10%,请你设计合理步骤,利用甲苯为原料,合成化合物C________。(注:苯甲酸的苯环上发生取代反应时,取代主要发生在羧基的间位)
(5) 请写出符合下列条件的所有E的同分异构体________。
a. 分子中含有一个萘环![]() ,且为萘的邻位二取代物(邻位不包括
,且为萘的邻位二取代物(邻位不包括 );
);
b. 分子中有一个五元环;
c. 1H-NMR显示分子中有8种氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种蓝黑色(有时是粉红色)的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:

请回答:
(1)已知化合物X中只含两种元素,则X中含有的元素是_____。
(2)请写出E反应生成F的化学方程式:_______________。
(3)化合物X与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,其原子半径、化合价等信息见下表。
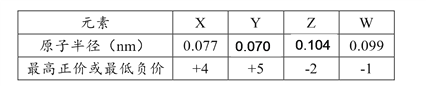
有关这四种元素的说法一定正确的是
A. X与W形成的化合物的电子式可表示为![]()
B. Y的氢化物能与W的氢化物反应,所得产物只含有共价键
C. X、Y能分别与氧元素形成多种氧化物
D. Z处于元素周期表中第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
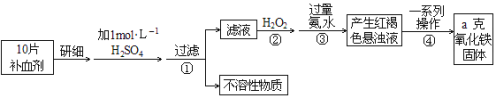
请回答下列问题:
(1)步骤②加入过量H2O2的目的:________________________________________;
(2)步骤③中反应的离子方程式:________________________________________;
(3)步骤④中一系列处理的操作步骤:________、洗涤、______、冷却、称量。
(4)实验中用浓硫酸配制1 mol/L的稀硫酸,配制时用到的定量玻璃仪器有________、__________。
(5)若实验无损耗,则每片补血剂含铁元素的质量___________g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参素的结构简式如下所示,有关它的说法错误的是( )
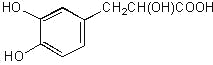
A. 1 mol丹参素能与3mol H2发生加成反应
B. 1 mol丹参素能与4mol NaOH发生反应
C. 能与NaHCO3、Na反应D. 可以发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 稀硝酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-=NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
D. HS-的电离:HS-+H2O![]() OH-+HS-
OH-+HS-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com