
| A | B | C | D | |
| 阳极 | 石墨棒 | Ag | Fe | Ag |
| 阴极 | 石墨棒 | 石墨棒 | Ag | Pt |
| 电解液 | CuCl2溶液 | 盐酸溶液 | H2SO4溶液 | H2O |
| A、A | B、B | C、C | D、D |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
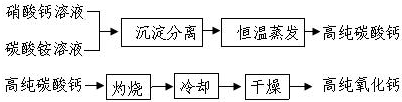
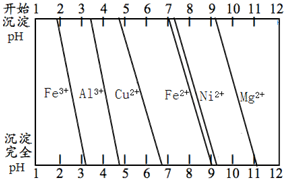 关于金属的冶炼和应用,有以下一些问题,请按要求回答问题.
关于金属的冶炼和应用,有以下一些问题,请按要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2S+SO2═3S↓+2H2O(复分解反应) | ||||
B、CO2+C
| ||||
C、2AgBr
| ||||
D、2Mg+CO2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上利用合成氨实现人工固氮 |
| B、SiO2有导电性,可用于制备光导纤维 |
| C、SO2具有氧化性,可用于漂白纸浆 |
| D、Zn具有还原性和导电性,可用作锌锰干电池的正极材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com