
| A. | pH=0的溶液呈中性 | |
| B. | 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12 | |
| C. | 溶液pH值越大,氢离子浓度越大 | |
| D. | 酸性溶液中,氢离子浓度一定大于氢氧根浓度 |
分析 A.pH=0的溶液呈酸性;
B.强碱溶液中溶质不一定为一元强碱;
C.氢离子浓度和氢氧根离子浓度乘积为常数,离子浓度为小于1的浓度;
D.溶液酸碱性取决于溶液中氢离子浓度和氢氧根离子浓度的相对大小.
解答 解:A.pH=0的溶液中氢离子浓度为1mol/L,溶液呈酸性,故A错误;
B.某强碱溶液的浓度为0.01 mol/L,若为一元碱则溶液PH=12,但若为二元碱氢氧根离子浓度为0.02mol/L,溶液PH不是12,所以某强碱溶液的浓度为0.01 mol/L,该溶液的pH值不一定为12,故B错误;
C.溶液pH值越大,氢氧根离子浓度越大,氢离子浓度越小,故C错误;
D.氢离子浓度大于氢氧根浓度,溶液显酸性,故D正确;
故选D.
点评 本题考查了溶液酸碱性的判断方法、溶液PH的计算、注意溶质成分,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
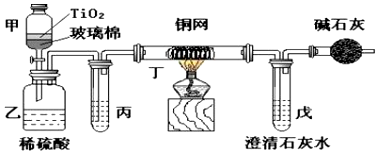
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2S>HF | B. | 稳定性:H2S<HF | ||
| C. | 一个D2O分子中所含的中子数为8 | D. | HCl的电子式为H+[:Cl:]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过石灰水 | |
| B. | 通过品红溶液 | |
| C. | 先通过小苏打溶液,再通过石灰水 | |
| D. | 先通过足量溴水溶液,再通过石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.
将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.| A. | ②③⑤ | B. | ⑤⑥ | C. | ②④⑥ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点的高低: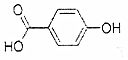 > > | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
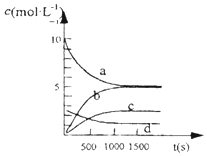 (1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(1)已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(ml) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com