
 下表是在0.1MPa下,不同温度时,二氧化硫催化氧化成三氧化硫的平衡转化率(原料气成分的体积分数:SO27%,O211%,N282%):
下表是在0.1MPa下,不同温度时,二氧化硫催化氧化成三氧化硫的平衡转化率(原料气成分的体积分数:SO27%,O211%,N282%):| 温度/℃ | 400 | 450 | 475 | 500 | 525 | 575 |
| 转化率/% | 99.2 | 97.5 | 95.8 | 93.5 | 90.5 | 79.9 |
| 实验 编号 |
压强(MPa) | SO2初始体积分数 (%) |
O2初始体积分数 (%) |
N2初始体积分数 (%) |
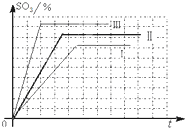
| Ⅰ | 0.1 | 7% | 11% | 82% |
| Ⅱ | ① | 7% | 15% | ② |
| Ⅲ | 0.5 | ③ | 15% | ④ |
 ,
, .
.


科目:高中化学 来源: 题型:
| A、一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
| B、D元素处于元素周期表中第3周期第IVA族 |
| C、A、C的最高价氧化物均为离子化合物 |
| D、四种元素的原子半径:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有化学变化一定遵循质量守恒和能量守恒 |
| B、所有化学变化的能量都可以通过原电池转化为电能 |
| C、化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
| D、断开旧化学键与形成新化学键之间的能量差只能以热量的形式释放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W四种短周期元素在元素周期表的位置如图.其中W的原子序数是Y的2倍.
X、Y、Z、W四种短周期元素在元素周期表的位置如图.其中W的原子序数是Y的2倍.| 催化剂 |
| 物质 | WY2 | XY | XY2 |
| 平衡浓度/mol?L-1 | 0.1 | 0.3 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 | 溶液先不显红色,加入氯水后变红色 | 该溶液中含有Fe2+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com