
A、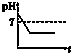 |
B、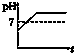 |
C、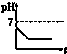 |
D、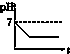 |
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、电解后溶液的pH为1.7 |
| B、电解后溶液的pH为0.7 |
| C、该金属的相对原子质量是65 |
| D、以上结论均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
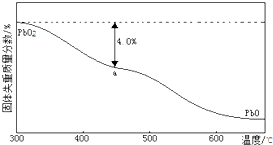
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3的喷泉实验说明氨气极易溶于水 |
| B、NO 和NH3均可用排空气法收集 |
| C、盛液溴的瓶内加少量水可防止液溴的挥发 |
| D、NH3遇到挥发性的强酸就能冒白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.001mol.L-1盐酸 |
| B、0.001mol.L-1的硫酸 |
| C、pH=11的NaCN溶液 |
| D、pH=11的KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 L该溶液中钠离子的物质的量浓度为0.2 mol/L |
| B、1 L该溶液中含有Na2CO3的质量为10.6 g |
| C、从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L |
| D、取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com