

分析 在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答.
解答 解:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答.
解:(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,检验氯离子的方法是:取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;用试管取少量X溶液,加入足量硝酸钡溶液,静置取上层清夜,滴加AgNO3溶液,无白色沉淀说明无Cl-;
(2)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,步骤②生成沉淀I的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol; 碳溶液中正电荷为:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2×0.03mol+3×0.01mol+0.01mol+0.04mol=0.14mol;沉淀C为硫酸钡,其物质的量0.07mol,n(SO42-)=0.07mol,硫酸根离子所带的负电荷为:0.07mol×2=0.14mol,说明溶液中正负电荷相等,所以若检验Fe3+肯定存在时,就有Cl-存在,因肯定存在的离子电荷总数已相等,
故答案为:不一定;若检验Fe3+肯定存在时,就有Cl-存在,因肯定存在的离子电荷总数已相等.
点评 本题考查物质的检验与鉴别,属于中等难度的试题,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,要依据物质的特殊性质和特征反应来判断、推理、验证.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
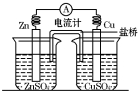 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )| A. | 构成原电池,锌片作正极 | |
| B. | 铜片附近Cu2+离子浓度减小 | |
| C. | 锌片上有铜析出,铜片上没有 | |
| D. | 导线中电流的方向是由锌片流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
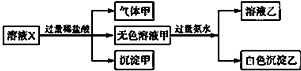
| A. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| B. | HCO3-和SO42-一定不存在于溶液X中 | |
| C. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| D. | 溶液中一定存在大量CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) | |
| B. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| C. | 反应进行到1 s时,v(A)=v(B) | |
| D. | 该反应的化学方程式为6A+2D?3B+4C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com