
(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
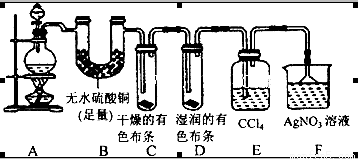
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
(20分)
(1)D(2分)
(2)4H++2Cl-+MnO2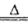 2H2O + Cl2↑+Mn2+;(3分)
2H2O + Cl2↑+Mn2+;(3分)
(3)随着反应的进行,盐酸浓度变稀将不再反应(3分,其他合理答案也给分)
(4)①证明有水蒸气产生,并吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;(3分)
②氯气无漂白性,次氯酸有漂白性(3分)
③吸收氯气(2分)
(5)E,F;(2分) AC(2分)
【解析】
试题分析:(1)制取氯气的方法由多种,但共同点有1个,都是浓盐酸作还原剂,所以合适的氧化剂与浓盐酸反应可以制取氯气,题目所给方法都可以,答案选D;
(2)实验室制取氯气采用MnO2和浓盐酸混合共热的方法,离子方程式为4H++2Cl-+MnO2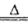 2H2O + Cl2↑+Mn2+;
2H2O + Cl2↑+Mn2+;
(3)二氧化锰与稀盐酸不反应,所以随着反应的进行,盐酸浓度变稀,反应停止,制得Cl2的体积(标况下)总是小于1.12L;
(4)①用无水硫酸铜来检验是否有水产生,若有,则固体颜色由白色变为蓝色,后面的实验要求氯气使干燥的,所以装置B同时还可以吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;
②干燥的有色布条不褪色说明氯气不具有漂白性,湿润的有色布条褪色,说明氯气与水反应产生的次氯酸具有漂白性;
③氯气在水中的溶解度不大,但在有机溶剂中的溶解度较大,所以装置E的作用是吸收多余的氯气;
(5)装置E吸收氯气,但不能证明氯气是否被吸收干净,所以在E、F间应加一个装置,用来检验氯气是否除尽,从而判断通入AgNO3溶液中的气体是否只有一种;检验氯气是否除尽的试剂可以是湿润的淀粉KI试纸,若试纸变蓝,说明氯气未除尽;还可以是湿润的红色布条,若布条褪色,说明氯气未除尽,反之则除尽,答案选AC。
考点:考查对制取氯气方法的判断,离子方程式的书写,试剂的选择,装置作用的判断及选择


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O HSO3-十OH— B.HSO3-十H2O
HSO3-十OH— B.HSO3-十H2O H2SO3十OH-
H2SO3十OH-
C.HSO3-十OH— SO32—十H2O D.H2SO3+OH-
SO32—十H2O D.H2SO3+OH- HSO3-十H2O
HSO3-十H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
反应4NH3+5O2=4NO+6H2O在5 L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率表达正确的是
A.v(O2)=0.01mol·L-1·s-1 B.v(NO)=0.008 mol·L-1·s-1
C.v(H2O)=0.003 mol·L-1·s-1 D.v(NH3)=0.004 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市红桥区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
化学与社会、生产、生活密切相关。下列说法正确的是
A.神舟10号飞船所用太阳能电池板的材料是单晶硅
B.用于制作集成电路板的酚醛树脂是天然高分子化合物
C.工业上获得大量乙烯、丙烯、丁二烯的方法是石油裂化
D.日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:选择题
下表是常温下的五种溶液,下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | ⑤ |
溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
pH | 11 | 11 | 3 | 3 | 8.3 |
A.表中五种溶液,其中①~④由水电离出的c(H+):②=④>①=③
B.在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+)
C.分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三总复习质量检测一理综化学试卷(解析版) 题型:选择题
下列选项中所涉及的两个量一定相等的是
A.电解精炼铜时阳极溶解与阴极析出的铜的质量
B.6.2gNa2O 和7.8gNa2O2 中所含的离子数
C.11.2 LN2与14gCO气体所含有的原子数
D.20g重水(D2O)与34gNH3 所含有的电子数
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三年级总复习质量检测三理综化学试卷(解析版) 题型:填空题
(15分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语
回答下列问题:
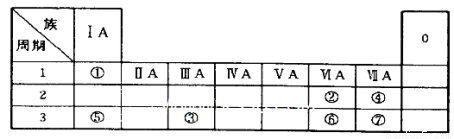
(1)④、⑤、⑦的原子半径由大到小的顺序为_______(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______>_______。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe+氧化,写出该反应的离子方程式_______。
(4)由表中元素形成的物质可发生如图中的反应,
其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式______________.
②写出检验A溶液中溶质的阴离子的方法:______________.
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为_______mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有_______ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:填空题
(14分)氮的化合物是中学化学的重要物质,与人类生活密切相关。
(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图所示:
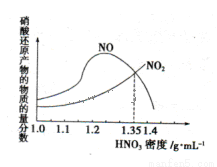
请写出铁与密度为1.35 g.m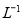 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为____。
(3)如图甲为NO2和C0反应生成CO2和NO过程的能量变化示意图,请写出该反应的热化学方程式:__________________________________________________________.
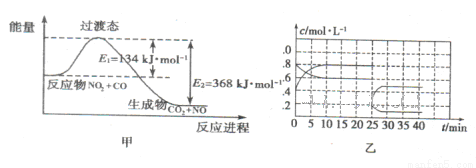
(4)已知NO2和N2O4可以相互转化:2NO2(g)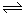 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
①前10 min内用NO2表示的平均反应速率v(NO2)= ;上述反应的平衡常数K=__________。
②反应进行至25 min时,曲线发生变化的原因是________________________.
③若要使上述反应的平衡常数K增大,采取的措施是_________________。
A.加入催化剂B.缩小容器体积C.降低温度 D.再加入一定量的NO2
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
据人民网报道,有一集团拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢气,其反应式可表示为:2H2O 2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
A.①② B.②③ C.③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com