
| �¶� | 25�桫550�桫600�桫700�� |
| ��Ҫ�ɷ� | WO3 W2O5 WO2 W |
���� ��1����ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ����ƽ��ʱ���������Ũ��ϵ������֮���뷴Ӧ���Ũ��ϵ������֮���ıȣ����塢��Һ�岻��Ҫ�ڻ�ѧƽ�ⳣ����д����
��2���ɷ�Ӧ����ʽ֪�����ĵ�H2�����ɵ�ˮ�����ʵ�����ȣ��ٶ�ƽ��ʱH2��ˮ���������ʵ����ֱ�Ϊ2mol��3mol���ٸ���ת���ʶ�����㣻
���¶ȵ����ߣ�H2��ˮ����������ȼ�С��˵�������¶�ƽ��������Ӧ�ƶ���
��3���ɱ�����Ҫ�ɷ����¶ȹ�ϵ��֪����һ�η�ӦΪWO3��H2��Ӧ��W2O5��ͬʱ������H2O����ƽ��д����ʽ��
580��ʱ���¶Ƚ���550�桫600�棬����ΪW2O5��WO2�Ļ���
���������εķ���ʽ���м�������������H2���ʵ���֮�ȣ�
��4����֪����WO2��s��+2H2��g���TW��s��+2H2O ��g����H=+66.0kJ•mol-1
��WO2��g��+2H2��g���TW��s��+2H2O ��g����H=-137.9kJ•mol-1
���ݸ�˹���ɣ���-�ڿɵã�WO2��s���TWO2��g������Ӧ��Ҳ������Ӧ�����㣻
��5���ɻ�ѧ����ʽ֪���ӷ���W��I2����γ���̬WI4�����������˶��Ľ����WI4���뻹û�лӷ���W�Ӵ����ڸ�����WI4�ֽ����ɵ�W�����ڻ�û�лӷ���W�ϣ��ƹܱ��¶Ƚϵͣ�WI4����ֽ⣬�����¶ȣ����淴Ӧ���ʶ��ӿ죮
��� �⣺��1��WO3��s��+3H2��g��$\stackrel{����}{?}$W��s��+3H2O��g����ƽ�ⳣ��k=$\frac{{c}^{3}��{H}_{2}O��}{{c}^{3}��{H}_{2}��}$���ʴ�Ϊ��$\frac{{c}^{3}��{H}_{2}O��}{{c}^{3}��{H}_{2}��}$��
��2���ɷ�Ӧ����ʽ֪�����ĵ�H2�����ɵ�ˮ�����ʵ�����ȣ���H2��ƽ��ת����Ϊ$\frac{3mol}{2mol+3mol}$��100%=60%��
�����¶ȣ�H2��ˮ����������ȼ�С��˵������ʱƽ�������ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ��60%�����ȣ�
��3���ɱ�����Ҫ�ɷ����¶ȹ�ϵ��֪����һ�η�ӦΪWO3��H2��Ӧ��W2O5��ͬʱ������H2O����Ӧ����ʽΪ��2WO3+H2$\frac{\underline{\;����\;}}{\;}$W2O5+H2O��580��ʱ���¶Ƚ���550�桫600�棬����ΪW2O5��WO2�Ļ���
�ٶ���2molWO3����2WO3+H2$\frac{\underline{\;����\;}}{\;}$W2O5+H2O��W2O5+H2?$\frac{\underline{\;����\;}}{\;}$2WO2+H2O��WO2+2H2?$\frac{\underline{\;����\;}}{\;}$W+2H2O��֪�����������ĵ����������ʵ���֮��Ϊ1mol��1mol��2mol��2=1��1��4��
�ʴ�Ϊ��2WO3+H2$\frac{\underline{\;����\;}}{\;}$W2O5+H2O��W2O5��WO2��1��1��4��
��4����֪����WO2 ��s��+2H2 ��g��?W ��s��+2H2O ��g������H=+66.0kJ•mol-1
��WO2 ��g��+2H2?W ��s��+2H2O ��g������H=-137.9kJ•mol-1
��-�ڵ���WO2 ��s��?WO2 ��g�����ʡ�H=66.0kJ•mol-1-��-137.9kJ•mol-1��=+203.9 kJ•mol-1��
�ʴ�Ϊ��+203.9 kJ•mol-1��
��5����������ѧ����ʽ֪���ӷ���W��I2����γ���̬WI4�����������˶��Ľ����WI4���뻹û�лӷ���W�Ӵ����ڸ�����WI4�ֽ����ɵ�W��I2������W�����ڻ�û�лӷ���W�ϣ��ƹ��ڵ�I2��ѭ��ʹ�ã���a��b�ԣ��ƹܱ��¶Ƚϵͣ�WI4����ֽ⣬��c���������¶ȣ�Ҳ�ܼӿ�W��I2�ķ�Ӧ���ʣ���d����
�ʴ�Ϊ��ab��
���� ���⿼�黯ѧƽ����㡢��ѧƽ�ⳣ������д����Ӧ�ȵļ��㡢��ѧƽ���ƶ�ԭ���ȣ���Ŀѡ����زıȽ�İ�����Կ���ѧ��������Ϊ�����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KClOΪ����������Ӧ�����б���ԭ | |
| B�� | K2FeO4�ǻ�ԭ���� | |
| C�� | K2FeO4��FeΪ+6�ۣ�����ǿ�����ԣ���ɱ������ | |
| D�� | ����2 mol FeCl3 ������Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ 6 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | H-H | N-H | N��N |
| ����/kJ•mol-1 | 436 | 391 | 945 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�
ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�| t/min | 0 | 1 | 2 | 3 | 4 |
| n��H2O��/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n��CO��/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
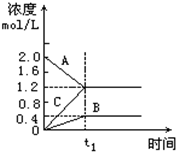 ��ͼ��ʾ800��ʱA��B��C�����������ʵ�Ũ����ʱ��ı仯�����t1�ǵ���ƽ��״̬��ʱ�䣬t1Ϊ2���ӣ��Իش�
��ͼ��ʾ800��ʱA��B��C�����������ʵ�Ũ����ʱ��ı仯�����t1�ǵ���ƽ��״̬��ʱ�䣬t1Ϊ2���ӣ��Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ң��� | B�� | ��=������ | C�� | �ң������� | D�� | ��=��=�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ۢ� | C�� | �٢ڢۢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com