
| A. | 苯中含有三个碳碳双键 | |
| B. | 乙酸中的官能团是羟基 | |
| C. | 乙醇不能与金属钠反应 | |
| D. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 |
分析 A.苯不含碳碳双键;
B.乙酸含有羧基;
C.羟基可与钠反应;
D.蒸馏法、电渗析法、离子交换法都可用于除去海水中的盐,是海水淡化的主要方法.
解答 解:A.苯中碳碳键介于单键和双键之间,不含碳碳双键,故A错误;
B.乙酸含有羧基,故B错误;
C.乙醇含有羟基,羟基可与钠反应,故C错误;
D.海水淡化水,应将水与盐分离,目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法、电渗析或离子交换法等等,其中最常用的是蒸馏法,目前多采用多级闪急蒸馏法,电渗析或离子交换法等,故D正确.
故选D.
点评 本题考查有机物的结构和性质、水的净化等知识,为高频考点,题目难度不大,试题涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和醇发生的反应一定是酯化反应 | |
| B. | 由乙烯生成乙醇属于还原反应 | |
| C. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠加入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
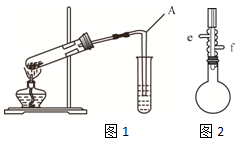 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,表格中给出了一些物质的物理常数,请回答下列问题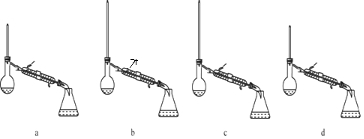
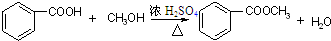 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油和自来水(蒸馏) | B. | 水溶液中的食盐和碘(分液) | ||
| C. | Fe(OH)3胶体中的HCl(过滤) | D. | SiO2和CaCl2(溶解、过滤、蒸发) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com