
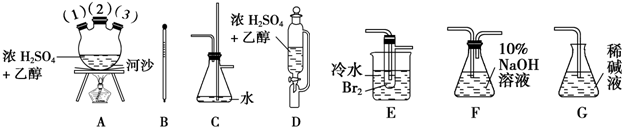
分析 以乙醇、浓硫酸和溴为原料制备1,2二溴乙烷.已知1,2二溴乙烷熔点为9℃,C2H5OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O,第一:必须除去混在乙烯中的气体杂质,尤其是SO2气体,以防止SO2与Br2发生反应SO2+Br2+2H2O=2HBr+H2SO4,影响1,2-二溴乙烷产品的制备;第二:必须在理解的基础上灵活组装题给的不太熟悉的实验仪器(如三颈烧瓶A、恒压滴液漏斗D、安全瓶防堵塞装置C),反应管E中冷水的作用是尽量减少溴的挥发,仪器组装顺序是:制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”,
(1)仪器组装顺序是:制取乙烯气体(用A、B、D组装)一安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G)”;
(2)仪器D的漏斗为恒压滴液漏斗,可以恒压分液,混合溶液加热需要防止暴沸;
(3)仪器C的两个作用是防止倒吸、避免装置内压强增大,气体通道被阻塞而发生危险;
(4)温度计的位置应位于三颈瓶的液体中央,插入溶液液面以下,但不能接触瓶底;
(5)溴易挥发,把反应管E置于盛有冷水的小烧杯中,可降低温度,减少挥发;
(6)若产物中有少量未反应的Br2,1,2二溴乙烷在氢氧化钠溶液中会水解,饱和亚硫酸氢钠溶液具有还原性可以和溴单质发生反应,碘化钠溶液和溴单质反应生成的碘单质,会溶解到生成的卤代烃;乙醇也会溶解1,2二溴乙烷;
(7)温度在140°C会发生反应生成乙醚,利用1,2-二溴乙烷与乙醚的沸点不同进行解答;
解答 解:(1)仪器组装顺序为:制取乙烯气体(用A、B、D组装)→安全瓶(C,兼防堵塞)→净化气体(F,用NaOH溶液吸收CO2和SO2等酸性杂质气体)→制备1,2-二溴乙烷的主要反应装置(E)→尾气处理(G),
故答案为:C;F;E;G;
(2)装置D为恒压滴液漏斗,该反应温度较高,容器内压强较大,若容器内压力过大时液体无法滴落,选用恒压滴液漏斗,可以平衡上下压强,使液体顺利滴下,河沙作用是防止溶液加热暴沸,
故答案为:平衡上下压强,使液体顺利滴下;防止暴沸;
(3)装置C为安全瓶,起到防止倒吸的作用,同时防止气体通道被阻塞而发生危险,
故答案为:安全瓶防止倒吸;防止气体通道被阻塞而发生危险;
(4)乙醇在浓硫酸作用下加热到1700C时发消去反应生成乙烯,则温度计的位置应位于三颈瓶的液体中央,插入溶液液面以下,但不能接触瓶底,
故答案为:温度计插入液面以下;位于三颈瓶的液体中央;不接触瓶底;
(5)溴易挥发,为减少挥发,在反应管E中加入少量水可起到水封的作用,把反应管E置于盛有冷水的小烧杯中,可降低温度,减少挥发,
故答案为:溴易挥发,可以减少溴的挥发;
(6)若产物中有少量未反应的Br2,
a.饱和亚硫酸氢钠溶液和溴单质发生氧化还原反应,可以除去溴单质,故a正确;
b.氢氧化钠溶液中溴单质发生反应,1,2二溴乙烷也会发生水解,不能除杂,故b错误;
c.碘化钠溶液和溴单质发生氧化还原反应生成碘单质也会溶于卤代烃,不能除杂,故c错误;
d.乙醇能溶解溴单质和卤代烃,不能除杂,故d错误;
故答案为:a;
(7)温度在140°C会发生反应生成乙醚,温度在170°C生成乙烯,产品中可能会有的有机杂质,分离混合物是利用1,2-二溴乙烷与乙醚的沸点不同,通过蒸馏方法分离,
故答案为:乙醚;蒸馏;
点评 本题考查有机物制备及性质实验方案的设计,题目难度中等,解答本题的关键是把握制备实验的原理,能正确设计实验顺序,牢固把握实验基本操作时解答该类题目的保证,学习中注意加强相关知识的全面把握.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 密度之比为7:11 | B. | 体积之比为11:7 | ||
| C. | 物质的量之比为7:11 | D. | 质量之比为11:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
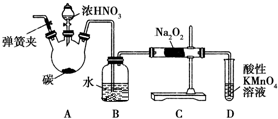 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示.已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示.已知:室温下,①2NO+Na2O2═2NaNO2;②3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
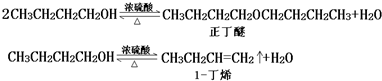
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
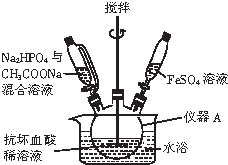 磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下:
磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com