
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 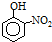 | 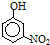 | 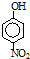 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
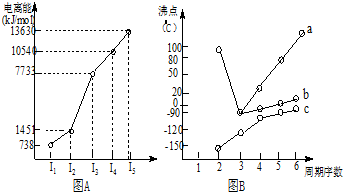
分析 (1)I.短周期某主族元素M的第一、第二、第三电离能之间变化不大,第四电离能剧增,易失去3个电子;
II.根据相对分子质量与物质熔沸点的关系以及氢键的存在对物质性质的影响判断;
由表中数据可知,从左到右由烷烃机物的相对分子质量逐渐增大,沸点逐渐升高,硝基苯酚中官能团的相对位置不同,熔点不同,结合氢键对物质的物理性质的影响解答该题;
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键;
(3)Ⅰ.钛元素在周期表中的原子序数为22,核外有22个电子;
Ⅱ.在原电池中作负极失电子被腐蚀,作正极被保护.
解答 解:(1)I.短周期某主族元素M的第一、第二、第三电离能之间变化不大,第四电离能剧增,且第一电离能很低,说明该元素原子很难失去第四个电子,易失去3个电子,最高化合价为+3,应为第IIIA族元素;
故答案为:IIIA;
II.在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;氢化物的沸点为100℃,则为水,第VIA族的氢化物沸点水的最高,a曲线中沸点高于100℃,不符合实际;
由表中数据可知,从左到右由烷烃机物的相对分子质量逐渐增大,沸点逐渐升高,硝基苯酚有三种同分异构体,其中邻位形成分子内氢键,熔点最低,对位形成分子间氢键,作用力最强,熔点最高;
故答案为:IVA;b;有机物相对分子质量越大,分子间作用力越强,故沸点越高;当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高;
(2)COCl2分子的结构式为 ,COCl2分子中C原子与Cl原子以单键相结合,与O原子以双键相结合,C=O键中含有1个δ键,1个π键,C原子为sp2杂化,
,COCl2分子中C原子与Cl原子以单键相结合,与O原子以双键相结合,C=O键中含有1个δ键,1个π键,C原子为sp2杂化,
故答案为:sp2;c;
(3)Ⅰ.钛元素在周期表中的原子序数为22,其基态原子的电子排布式为1s22s22p63S23p63d24s2,则基态原子的价电子层排布式为3d24s2,
故答案为:3d24s2;
Ⅱ.根据原电池原理可知,在原电池中负极发生氧化反应,所以钢铁表面镀有活泼性强于铁的金属时,当镀层部分被破坏时,铁不易被腐蚀而是镀层被腐蚀,题中锌比铁活泼,其它金属都没有铁活泼,
故选:b.
点评 本题对物质结构与性质进行综合性考查,侧重考查学生运用所学知识对图表、图象分析本题,主要考查了COCl2的结构、杂化类型的判断、电子排布式、氢键等,掌握杂化轨道理论是解答的关键,题目难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
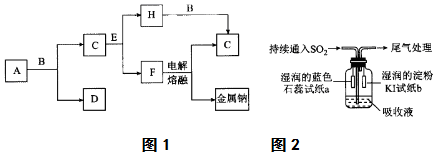
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液一定显酸性 | B. | 溶液一定显碱性 | ||
| C. | 溶液一定不显中性 | D. | 溶液可能显酸性.也可能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
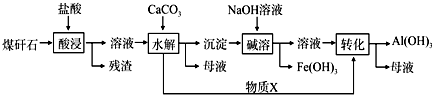
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
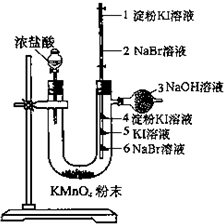 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):PbO2>Fe3+>S | |
| B. | 还原性(碱性溶液):Fe(OH)2>KCl>Cl2 | |
| C. | 酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 | |
| D. | 热稳定性:CaCO3>FeCO3>Ag2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
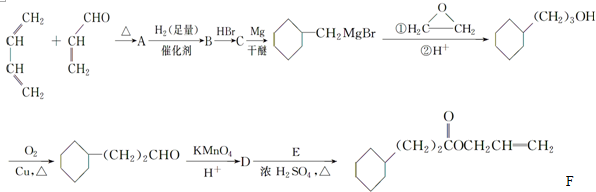
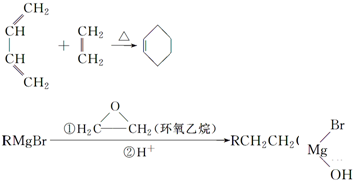

 .
. .
.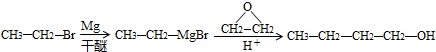 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com