
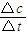 计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2); CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol?1,
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol?1, CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol?1;
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol?1;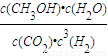 ;故答案为:
;故答案为: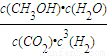 ;
;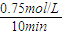 =0.075mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L?min)=0.225mol/(L?min),故答案为:0.225mol/(L.min);
=0.075mol/(L?min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L?min)=0.225mol/(L?min),故答案为:0.225mol/(L.min);

科目:高中化学 来源: 题型:阅读理解
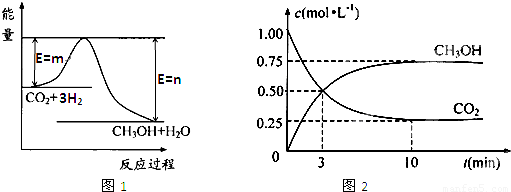
 法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)
法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
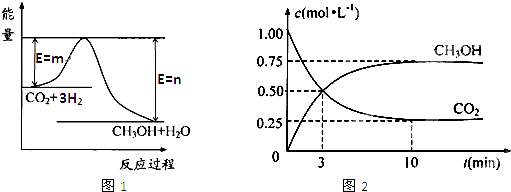
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
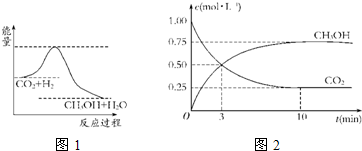
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 光合 |
| 作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
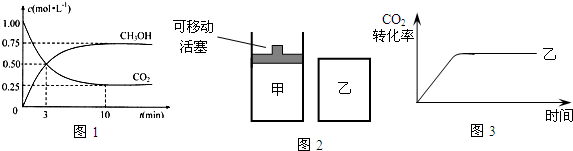
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com