
 �״�������ˮ������Ӧ������������Ӧ����ʽ���£�CH3OH��g��+H2O��g��?CO2��g��+3H2��g����H��0
�״�������ˮ������Ӧ������������Ӧ����ʽ���£�CH3OH��g��+H2O��g��?CO2��g��+3H2��g����H��0���� ��1�����ݻ�ѧƽ������ʽ��ʽ����״���Ũ�ȱ仯�����빫ʽv=$\frac{��c}{��t}$���㣻
��2����Ӧ�ﵽƽ��ı�־�����淴Ӧ������ͬ������ֺ������ֲ��䣬���������Ĺ�ϵ�������������ж����ݣ�
��3�������ݺ��º��ݡ����º�ѹ�����仯����Ϸ�Ӧƽ�����������жϣ�ѹǿ�仯�����ʵ����仯�����ȣ�
�ڴ�KAB��ɵ��Ǻ��º�ѹ����������ѹǿ�仯�����ʵ����仯�����ȼ���õ���
��� �⣺��1��һ�������£������2L���ܱ������г���1molCH3OH��g����3molH2O��g������״���Ӧ���ʵ���Ϊx
CH3OH��g��+H2O��g��?CO2��g��+3H2��g����
��ʼ����mol�� 1 3 0 0
�仯����mol�� x x x 3x
ijʱ������mol��1-x 3-x x 3x
20s��û�������ѹǿ�Ƿ�Ӧǰ��1.2����4+2x=4��1.2�����x=0.4mol��
v��CH3OH��=$\frac{0.4mol}{2L��20s}$=0.01mol/L•s��
�ʴ�Ϊ��0.01mol/L•s��
��2��CH3OH��g��+H2O��g��?CO2��g��+3H2��g�����÷�Ӧ������ӦΪ���������������ȷ�Ӧ��
��v����CH3OH��=v����CO2����������Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����A����
�ڷ�Ӧǰ�������������䣬������䣬���������ܶ�ʼ�ղ��䣬����˵����Ӧ�ﵽƽ��״̬����B����
�۷�Ӧǰ���������ʵ����仯�������������䣬��������ƽ����Է����������䣬˵����Ӧ�ﵽƽ��״̬����C��ȷ��
��CH3OH��H2O��CO2��H2��Ũ�ȶ����ٷ����仯��ƽ���־����D��ȷ��
�ʴ�Ϊ���ۢܣ�
��3����B�����������Ϊԭ����1.5�������ӵ���������ʵ���Ϊ3.6 mol��0.5=1.8 mol�����ݻ�ѧ����ʽ��֪����2mol����Ӧ�״�1mol����Ӧ�ļ״������ʵ���Ϊ0.9 mol��CH3OH��ת����=$\frac{0.9mol}{1.2mol}$��100%=75%��
A�Ǻ��ݷ�Ӧ������B�Ǻ�ѹ��Ӧ������B��������1.2molCH3OH��g�� ��2.4molH2O��g����B��������1molCH2OH��g����2molH2O��g�����ǵ�Чƽ�⣮��Ӧ����ʽ���������������࣬��ӦʱA����ѹǿ��B����������A��ƽ��ʱ�൱��Bƽ���ļ�ѹ����ѹƽ�����淴Ӧ�����ƶ���A������H2O�ٷֺ������࣬��B����A����
�ʴ�Ϊ��75%������
�ڴ�Kʱ��AB���һ�����µ�ѹ��������Ӧ����ʼͶ�������ʵ�����ƽ�������������ȣ����K���´ﵽƽ����ܵ����Ϊx����x����3+3.6��=1.5a��3.6�����x=2.75a������B�����Ϊ2.75a-a=1.75a��
�ʴ�Ϊ��1.75a��
���� ���⿼���˻�ѧƽ������ʽ���㣬ƽ���־�ķ����жϣ���Ŀ�ѶȽϴ��º������������º�ѹ�����ķ����ж��ǽ���ؼ�������ѹǿ֮�Ⱥ����ʵ���֮�ȳ���������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
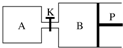
 Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�죮
Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�죮| ʵ���� | ʵ��Ŀ�� | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| �� | Ϊ����ʵ�������� | 298 | 3 | 6.0 | 0.30 |
| �� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | 3 | |||
| �� | 298 | 10 | 6.0 | 0.30 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ܢ� | B�� | �ڢۢ� | C�� | �٢� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
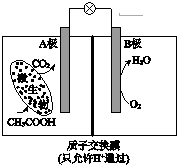
| A�� | ���·���Ӵ�B������A�� | |
| B�� | ��Һ��H+��B��������A���� | |
| C�� | ��ع���һ��ʱ���B������Һ��pH��С | |
| D�� | A���缫��ӦʽΪ��CH3COOH-8e-+2H2O=2CO2+8H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ��������X��Y | |
| B�� | �ǽ����ԣ�X��Y | |
| C�� | ����������Ӧ��ˮ�������ԣ�X��Y | |
| D�� | ԭ�Ӱ뾶��X��Y |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ά��ǿ��ᡰ��·�� | |
| B�� | ƻ�����ڿ����о��ñ�ƺ�ֽ�ž��ñ��ԭ������ | |
| C�� | ���������������ڽ��ػ����������������ָ��£������������ǽ������� | |
| D�� | ����-20���ɻ���ʹ�õ�̼��ά��һ�����͵��л��߷��Ӳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ۢܢ� | C�� | �ڢۢ� | D�� | �ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
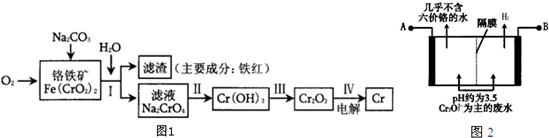
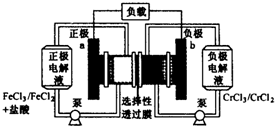 ����������ԭҺ�������һ�ֵͳɱ��Ĵ��ܵ�أ���ؽṹ����ͼ��ʾ������ԭ��Ϊ��Fe3++Cr2+$?_{���}^{�ŵ�}$Fe2++Cr3+������˵����ȷ���ǣ�������
����������ԭҺ�������һ�ֵͳɱ��Ĵ��ܵ�أ���ؽṹ����ͼ��ʾ������ԭ��Ϊ��Fe3++Cr2+$?_{���}^{�ŵ�}$Fe2++Cr3+������˵����ȷ���ǣ�������| A�� | ��س��ʱ��b���ĵ缫��ӦʽΪCr3++e-=Cr2+ | |
| B�� | ��س��ʱ��Cl-��a������ѡ������Ĥ����b�� | |
| C�� | ��طŵ�ʱ��a���ĵ缫��ӦʽΪFe3++3e-=Fe | |
| D�� | ��طŵ�ʱ����·��ÿͨ��0.1mol���ӣ�Fe3+Ũ�Ƚ���0.1 mol•L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com