
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(X)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(Y)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前10 min的平均速率为v(Z)=0.01mol•L-1•min-1 | |
| B. | 保持其他条件不变,降低温度,平衡时,c(X)=0.08mol•L-1,则a>0 | |
| C. | 恒压,其他条件不变,向容器中充入不参与反应的氮气作为稀释剂,X的转化率大于50.0% | |
| D. | 保持其它条件不变,再向容器中充入0.10 mol Y和0.10 mol Z,达到平衡后,该反应的平衡常数为0.2 |
分析 由表格数据及反应可知,n1=0.26,n2=n3=0.20,则30min达到平衡,
X(g)?Y(g)+Z(g)
开始 0.2 0 0
转化 0.1 0.1 0.1
平衡 0.1 0.1 0.1
A.结合v=$\frac{△c}{△t}$计算;
B.由上述分析可知,平衡时,c(X)=0.1mol•L-1,由降低温度,平衡时,c(X)=0.08mol•L-1,可知降温平衡正向移动;
C.恒压,其他条件不变,向容器中充入不参与反应的氮气作为稀释剂,对反应来说,压强减小,平衡正向移动;
D.结合平衡浓度计算K,K只与温度有关.
解答 解:A.速率之比等于化学计量数之比,反应在前10 min的平均速率为v(Z)=v(X)=$\frac{\frac{0.1mol}{2L}}{10min}$=0.005mol•L-1•min-1,故A错误;
B.由上述分析可知,平衡时,c(X)=0.1mol•L-1,由降低温度,平衡时,c(X)=0.08mol•L-1,可知降温平衡正向移动,则正反应为放热反应,即a<0,故C错误;
C.X的转化率为$\frac{0.1}{0.2}$×100%=50%,恒压,其他条件不变,向容器中充入不参与反应的氮气作为稀释剂,对反应来说,压强减小,平衡正向移动,则X的转化率大于50.0%,故C正确;
D.由平衡浓度可知K=$\frac{0.1×0.1}{0.1}$=0.1,K只与温度有关,保持其它条件不变,再向容器中充入0.10 mol Y和0.10 mol Z,达到平衡后,该反应的平衡常数仍为0.1,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握表中数据、平衡三段法、速率和转化率的计算为解答的关键,侧重分析与计算能力的考查,注意K只与温度有关,题目难度中等.


科目:高中化学 来源: 题型:解答题
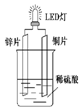 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 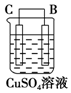 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | $\frac{1}{3}$ | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224mL | D. | 672mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com