
【题目】下列只含有共价键的化合物是( )
A. NH4NO3B. Cl2C. HClD. NaOH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是
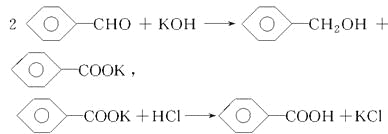
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
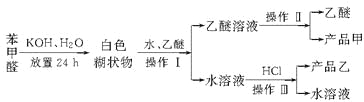
试根据上述信息,判断以下说法错误的是( )
A. 操作Ⅰ是萃取分液
B. 乙醚溶液中所溶解的主要成分是苯甲醇
C. 操作Ⅱ蒸馏所得产品甲是苯甲醇
D. 操作Ⅲ过滤得到产品乙是苯甲酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是重要的化工原料,也是重要的工业溶剂。实验室制备环己酮的原理、有关数据及装置示意图如下:
反应原理:
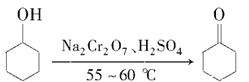
反应放热,温度过高或者重铬酸钠过量会进一步氧化.
主要物料及产物的物理参数:
名称 | 溶解度 | 密度 | 熔点℃ | 沸点℃ | 溶解度 | |
水 | 乙醚 | |||||
环己醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL |
|
环己酮 | 无色,有枣激性气味 | 0.9478 | —— | 155.7 | 2.4g/100mL |
|
实验装置:
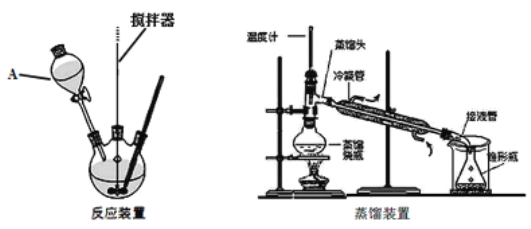
实验步骤:
①投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下。将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用.
②反应:将约1/5的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀。冷水浴冷却,控制反应温度在55-60℃。待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中,当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
③蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90-99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
④萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层。水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥;5.蒸馏,收集环己酮产品2.6g。
请回答下列问题:
(1)装置A的名称是
(2)完成并配平反应方程式:
_____![]() +_____Na2Cr2O7+____H2SO4→____
+_____Na2Cr2O7+____H2SO4→____![]() +____Na2SO4+____Cr2(SO4)3+___H2O___________
+____Na2SO4+____Cr2(SO4)3+___H2O___________
(3)反应过程中加入甲醇后有无色气体生成。加入甲醇的作用是______,请用离子方程式表示反应原理________.
(4)步骤4向馏出液加入食盐的目的是_________,将乙醚提取液和有机层合并的原因是_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,错误的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 含有5个碳原子的饱和链烃,其一氯取代物共有8种
C. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
D. 菲的结构简式为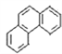 ,可有5种一氯取代物
,可有5种一氯取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. PH4+、 PO43-、XeO4 的空间构型均为正四面体形
B. CO32-、 NO3-、CH2O的空间构型均为平面三角形
C. NH2-、NF3、Cl2O、 I3- 的VSEPR 模型名称均为四面体形
D. 微粒 N2H5、 NH4 、Fe(CO)3、Fe(SCN)3、H3O+、[Ag(NH3)2]OH 中均含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征三号甲运载火箭(CZ—3A)与“嫦娥工程“太空摆渡车”“北斗卫星”“风云卫星”等中国航天大事件紧密相连。它是大型三级液体推进剂火箭,一子级和二子级均使用偏二甲肼(UDMH)-四氧化二氮(NTO)推进剂,反应产物绿色无污染。回答下列问题:
(1)已知(CH3)2NNH2(l)+4O2(g)= 2CO2(g)+4H2O(g)+N2(g) △H=a kJ/mol
N2(g)+O2(g)= 2NO(g) △H=b kJ/mol
2NO(g)+O2(g)= N2O4(l) △H=c kJ/mol
则UDMH-NTO推进剂反应的热化学方程式为________________________。
(2)偏二甲肼易溶于水,其一水合物的电离方式与一水合氨(Kb=1.7×10-5)相似但电离常数更小,偏二甲肼一水合物的电离方程式为___________________,向偏二甲肼溶液中加入等物质的量的醋酸(Ka=-1.7×10-5),充分反应后溶液呈______(填“酸性”“碱性”或“中性”)。碱性偏二甲肼—空气燃料电池的电解质溶液是20~30%的KOH溶液,电池工作时正极的电极反应式为__________________________。
(3)N2O4是NO2的二聚产物,NO、NO2等氮氧化物是主要的大气污染物,氮氧化物与悬浮在大气中的微粒相互作用时,涉及如下反应:
(I)2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0 K1
NaNO3(s)+ClNO(g) △H1<0 K1
(II)2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 K2
2ClNO(g) △H2<0 K2
则4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+C12(g)的平衡常数为_______(用K1、K2表示);为研究不同条件对反应(Ⅱ)的影响,T℃时,向2L恒容密闭容器中加入0.2mol NO和0.2mol C12,5min时达到平衡,反应过程中容器内的压强减小了10%,则5min内反应的平均速率v(C1NO)=_____mol/(L·min),NO的平衡转化率α1=_____%;若其他条件保持不变,使反应(Ⅱ)在初始容积为2L的恒压密闭容器中进行,则NO的平衡转化率α2_______α1(填“>”“<”或“=”)。
2NaNO3(s)+2NO(g)+C12(g)的平衡常数为_______(用K1、K2表示);为研究不同条件对反应(Ⅱ)的影响,T℃时,向2L恒容密闭容器中加入0.2mol NO和0.2mol C12,5min时达到平衡,反应过程中容器内的压强减小了10%,则5min内反应的平均速率v(C1NO)=_____mol/(L·min),NO的平衡转化率α1=_____%;若其他条件保持不变,使反应(Ⅱ)在初始容积为2L的恒压密闭容器中进行,则NO的平衡转化率α2_______α1(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com