
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)___c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是___(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH)=____。
(2)某温度下,pH=3的盐酸中[OH-]=10-9mol/L。该温度下, pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为____。
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
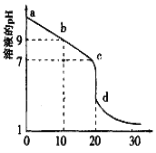
①d点所示的溶液中离子浓度由大到小的顺序依次为______。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=_____(写出准确数值)。
【答案】< CBA CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O![]() CH3COOH+OH- l.8×104 9:1 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2(10-5-10-9)
CH3COOH+OH- l.8×104 9:1 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2(10-5-10-9)
【解析】
(1)①根据表格中数据可知,HCN电离出的H+小于H2CO3电离出H+能力,根据盐类水解中越弱越水解,即CN-水解的能力强于HCO3-,因此等浓度的NaCN溶液和NaHCO3溶液中,c(CN-)<c(HCO3-);
②电离平衡常数越小,酸越弱,因此根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN>HCO3-。酸越弱,相应的钠盐越容易水解,溶液的pH越大,则等物质的量浓度的A.CH3COONa、B.NaCN、C.Na2CO3的pH由大到小的顺序为C>B>A,故答案为:CBA。
③HCN的电离平衡常数Ka=4.3×10-10,H2CO3的电离平衡常数是Ka1=5.0×10-7、Ka2=5.6×10-11,由此可知电离出H+能力强弱程度为H2CO3>HCN>HCO3-,所以NaCN溶液通入少量CO2的离子方程式是:CN-+CO2+H2O=HCN+HCO3-;
④CH3COONa是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,水解离子反应方程式为CH3COO-+H2O![]() CH3COOH+OH-,
CH3COOH+OH-,![]() =
=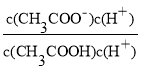 =
=![]() =
=![]() =l.8×104;
=l.8×104;
(2)该温度下,pH=3,即c(H+)=10-3mol/L,而c(OH-)=10-9mol/L,则Kw=10-12,pH=11的NaOH溶液c(OH-)=0.1mol/L,pH=2的H2SO4溶液c(H+)=0.01mol/L,混合后pH变为9,设酸的体积为V1,碱的体积为V2,则混合溶液中c(OH-)=10-3mol/L=![]() =
=![]() ,V1:V2=9:1;
,V1:V2=9:1;
(3)①d点酸碱恰好完全反应生成氯化铵,氯化铵水解导致溶液呈酸性,c(H+)>c(OH-),结合电荷守恒可得c(NH4+)<c(Cl-),但其水解程度较小,d点所示的溶液中离子浓度由大到小的顺序依次为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
②b点溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(C1-),存在物料守恒:c(NH3·H2O)+c(NH4+)=2c(C1-),所以得到:2c(H+)+ c(NH4+)=2c(OH-)+ c(NH3·H2O),则c(NH4+)-c(NH3·H2O)=2c(H+)-2c(OH-);
(4)溶液中含S的微粒有H2SO![]() ,在pH=1.91时,含HSO3-的物质的量分数为50%,此时可以近似认为c(H2SO3)=c(HSO3-),则Ka1≈c(H+),即pKa1=-lgKa1≈1.91。
,在pH=1.91时,含HSO3-的物质的量分数为50%,此时可以近似认为c(H2SO3)=c(HSO3-),则Ka1≈c(H+),即pKa1=-lgKa1≈1.91。


科目:高中化学 来源: 题型:
【题目】白藜芦醇是一种抗肿瘤的药物,合成它的一种路线如图:
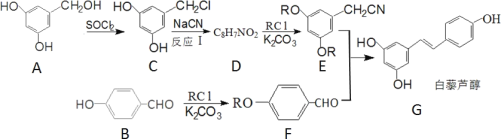
回答下列问题:
(1)B 的化学名称是_______;G 中含有的官能团名称是_________。
(2)反应I的反应类型为____________。
(3)D 的结构简式是______________。
(4)B的芳香类同分异构体中可以发生水解的结构简式为_____________;该有机物在 NaOH溶液作用下完全水解的化学反应方程式为______________。
(5)据已有知识并结合相关信息,写出以 ![]() 和 CH3OH 为原料制备
和 CH3OH 为原料制备 ![]() 的合成路线流程图______________(无机试剂任用)。 (已知 RCN
的合成路线流程图______________(无机试剂任用)。 (已知 RCN![]() RCOOH)合成路线流程图如下: (甲
RCOOH)合成路线流程图如下: (甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用的几种气体发生装置如图A、B、C所示:
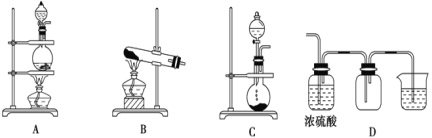
(1)实验室用熟石灰和氯化铵固体制取氨气,应选择____装置,检验该装置气密性的操作方法是_________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是____(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的____。
① CO2 ② H2 ③ Cl2
Ⅰ.写出A装置中反应的离子方程式___________________________。
Ⅱ.D装置中小烧杯中应盛放____,目的是_________________。
Ⅲ.若要收集干燥纯净的X气体,上述装置应如何改进:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p(Ba2+) ═ -lgc(Ba2+),p(X2-) ═ -lgc(X2-) ,Ksp(BaSO4)<Ksp(BaCO3),常温下BaSO4、BaCO3的溶解平衡曲线如图所示,下列叙述中正确的是( )

A.M线为BaCO3的溶解平衡曲线B.b点对应的溶液中Ba2+、SO42-不能形成BaSO4沉淀
C.Ksp(BaSO4) > 10-(1+a)D.BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42-(aq)的K=0.1
BaCO3(s)+SO42-(aq)的K=0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
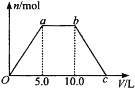
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02倍誉为“摩尔日”(Mole Day),这个时间的美式写法为6:02 10/23,外观与阿伏伽德罗常数6.02×1023相似。设NA为阿伏伽德罗常数的值,下列说法正确的是
A.7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA
B.1L0.1mol·L-1碳酸钠溶液中含有的氧原子数为0.3NA
C.将100mL 0.1mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数为0.01NA
D.将CO2通过0.1mol Na2O2时,反应共转电子数为移0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①乙醇 ②铜 ③CaO ④CO2 ⑤食醋 ⑥Ba(OH)2⑦红褐色氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩硫酸铁
(1)按物质的分类方法填写表格的空白处:
分类标准 | _______ | 氧化物 | _____ | _____ | 电解质 | 非电解质 |
物质 | ② | _____ | ⑤⑧⑨ | ⑦ | _____ | _____ |
(2)上述十种物质中有两种物质之间可发生离子反应:OH-+ H+=H2O,该反应对应的化学方程式为________________________________。
(3)少量的②加入的溶液中反应⑩的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设 NA 表示阿伏加德罗常 数的值)。
(1)标准状况下,0.2 mol 氨气的体积是_______________,含氢原子数是_______________。
(2)H2SO4 的摩尔质量是_______________, 49 g 的 H2SO4 中含有_______________mol 氧原子,能与_______________mol NaOH 恰好完 全反应。
(3)将 0.5 mol Na2CO3溶解在水中,配成 500mL 溶液,所得溶液中溶质的物质的量浓度是 ______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com