
| A. | B60和C90都属于新型化合物 | B. | C60和N60属于同分异构体 | ||
| C. | B60、C60、C90、N60都只含共价键 | D. | B60、C60、C90、N60都属于烯烃 |
科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴、阳离子间只存在静电吸引力 | |
| B. | 核外电子排布相同的微粒,化学性质相同 | |
| C. | 所有物质中均存在化学键 | |
| D. | 离子化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
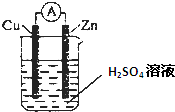 某学习小组针对化学能转变为其他形式的能量,进行如下实验:
某学习小组针对化学能转变为其他形式的能量,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
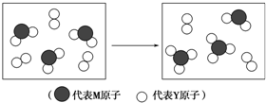
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ⅰ | A、B、C、D、E、F、G七种短周期元素的原子序数依次增大 |
| Ⅱ | A和E同主族,B和F同主族,D和G同主族 |
| Ⅲ | A原子核内只有质子没有中子,B原子最外层电子数是电子层数的2倍 |
| Ⅳ | D和F以原子个数比为2:1组成的物质X是光导纤维的主要成分 |
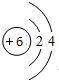 ,物质X的化学式为SiO2
,物质X的化学式为SiO2查看答案和解析>>
科目:高中化学 来源: 题型:解答题

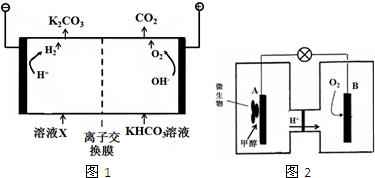
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硫酸中加入氢氧化钡溶液:OH-+H+═H2O | |
| B. | 铜与稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向氯化铁溶液中加入过量铜:Fe3++Cu═Fe+Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com