
| A. | c(B+ )>c(A- )>c(OH- )>c(H+) | B. | c(A-)>c(B+ )>c(H+ )>c(OH-) | ||
| C. | c(B+)=c(A- )>c(H+)=c(OH-) | D. | c(B+ )>c(A- )>c(H+ )>c(OH-) |
分析 实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,证明酸为一元强酸;0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12,依据离子积常数c(H+)c(OH-)=10-14计算得到溶液中氢氧根离子浓度为0.1mol/L,说明碱为强碱;依据强酸强碱反应后的溶液中物质和离子分析选项.
解答 解:实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,证明酸为一元强酸;0.1mol/L某一元碱(BOH)溶液里解:实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,证明酸为一元强酸;0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12,依据离子积常数为c(H+)c(OH-)=10-14;计算得到溶液中氢氧根离子浓度为0.1mol/L,说明碱为强碱;
一元强酸和一元强碱恰好反应生成强酸强碱盐BA,溶液呈中性,则:(H+)=c(OH-),依据溶液中电荷守恒c(B+)+c(H+)=c(A-)+c(OH-)可得:c(B+)=c (A-),溶液中离子浓度大小为:c(B+)=c(A-)>c(H+)=c(OH-),故C正确,
故选C.
点评 本题考查了酸碱混合定性判断及溶液pH的计算、离子浓度大小比较,题目难度中等,根据酸碱溶液的浓度和pH判断强弱电解质为解答关键,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | NaOH溶液 | C. | KSCN溶液 | D. | NH3•H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H2和2H2互为同位素 | |
| B. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 | |
| C. | 乙烯和乙炔是同系物 | |
| D. | ${\;}_{8}^{16}O$、${\;}_{8}^{17}O$、${\;}_{8}^{18}O$互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
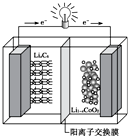 某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )
某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )| A. | 放电时LixC6发生氧化反应 | |
| B. | 充电时将电池的负极与外接电源的负极相连 | |
| C. | 充电时,Li+通过阳离子交换膜从左向右移动 | |
| D. | 放电时,电池的正极反应为Li1-xCoO2+xLi++xe-═LiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质的溶解平衡是一种动态平衡 | |
| B. | 达到溶解平衡时,沉淀的速率和溶解的速率相等,溶液中离子的浓度保持不变 | |
| C. | 达到溶解平衡时,溶液中各种离子的浓度不一定相等 | |
| D. | 达到溶解平衡时,再加入该难溶电解质,将促进其溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O为电池的正极 | B. | Al在电池反应中被氧化 | ||
| C. | 电子由Ag2O极经外电路流向Al极 | D. | 溶液中的OH-向Al极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com