
| A. | 1 mol任何物质中都含有6.02×1023个分子 | |
| B. | 0.012 kg 12C中含有约6.02×1023 NA个碳原子 | |
| C. | 1 mol水中含有1 mol氢分子和1 mol氧原子 | |
| D. | 1 mol Ne中约含有6.02×1024个电子 |
分析 A.物质不全都是由分子构成;
B.依据阿伏伽德罗常数的规定分析判断;
C.水是由氢原子和氧原子构成;
D.稀有气体是单原子分子,每个氖原子含有10个电子
解答 解:A.物质不全都是由分子构成,例如氯化钠不含分子,故A错误;
B.依据阿伏伽德罗常数的规定可知,0.012 kg碳-12含有碳原子数为1mol,约6.02×1023个碳原子,故B正确;
C.水分子中不含氢分子,故C错误;
D.稀有气体是单原子分子,每个氖原子含有10个电子,1molNe中约含有6.02×1o24个电子,故D正确;
故选:BD.
点评 本题考查了有关物质的量、摩尔质量、摩尔体积等几个概念,侧重于基础知识的考查,题目难度不大,注意气体摩尔体积使用条件和对象.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| C. | 0.5 mol•L-1MgCl2溶液中,含有Cl-个数为NA | |
| D. | 18 g NH4+中所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子式: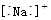 | B. | Na+的结构示意图: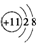 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
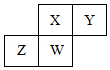 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| B. | 最高价氧化物对应的水化物的酸性:X>W>Z | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 元素X、Z、W的最高正价分别与其主族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol Al与足量盐酸反应转移电子数为1NA | |
| B. | 500mL 1mol/LNa2CO3溶液中,含有Na+离子数目为NA | |
| C. | 常温常压下,11.2LO2(g)中含有O2分子数目为0.5NA | |
| D. | 标准状况下,11.2 L H2O所含的分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO (g)+2H2 (g)═CH3 OH(g) | △H1=-90.8kj/mol | k1=160(mol/L)-2 |
| ②CO2 (g)+H2 (g)═CO (g)+H2 O(g) | △H2=-41.2kj/mol | K2 |
| ③3H2 (g)+CO2 (g)═H2 O(g)+CH3 OH(g)△H 3 | △H3 | K3=160(mol/L)-2 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol/L) | 0.2 | 0.2 | 0.4 | 0.4 |
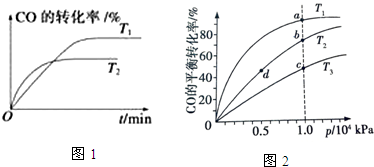
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com