
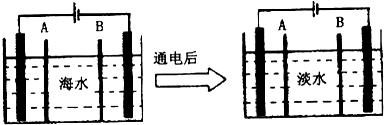
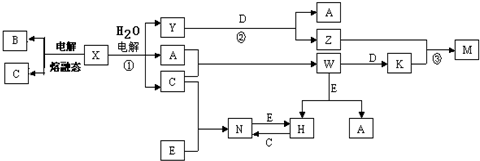
分析 (1)水处理技术的核心是减少或除去水中的各种杂质离子,主要的去离子方法是离子交换法和膜分离法;
(2)二氧化氯中氯为+4价,CN-中氮为-3价,碳为+2价;
(3)根据地下水硬度较大,需要软化;用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;
(4)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②先用稀盐酸排除干扰离子,然后用氯化钡溶液具有硫酸根离子;
③根据阳极是氯离子放电写出电极反应式.
解答 解:(1)水处理技术的核心是减少或除去水中的各种杂质离子,主要的去离子方法是离子交换法和膜分离法,
故答案为:离子交换法;
(2)ClO2氧化性较强,是常用的氧化剂,其中+4价氯元素通常被还原为-1价,在该反应中而CN-中+2价碳元素通常被氧化成+4价,而氮元素则容易被还原成0价形成氮气:2CN-+2ClO2=2CO2↑+N2↑+2Cl-,
故答案为:2CN-+2ClO2=2CO2↑+N2↑+2Cl-;
(3)地下水硬度较大,需要软化,所以自来水厂需要对地下水进行软化;
用磺化煤(NaR)作离子交换剂:2NaR+Ca2+=CaR2+2Na+,2NaR+Mg2+=MgR2+2Na+,用5%-8%的食盐水浸泡可使失去软化能力的磺化煤再生:CaR2+2Na+=2NaR+Ca2+,MgR2+2Na+=2NaR+Mg2+;
故答案为:软化;5%-8%的食盐水;
(4)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,
故答案为:B;
②检验硫酸根离子的方法为:先加入足量稀盐酸,无明显现象,再加入几滴氯化钡溶液,若醋酸白色沉淀,说明含有SO42-,
故答案为:先加入足量稀盐酸,无明显现象,再加入几滴氯化钡溶液,若醋酸白色沉淀,说明含有SO42-;
③阳极是氯离子放电,电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑.
点评 本题考查海水资源的综合利用,题目难度中等,注意掌握海水资源的综合利用方法,本题是一道化学和生活相结合的题目,注重知识的迁移应用,能较好的考查学生分析和解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,应将NaOH固体放在小烧杯或玻璃器皿中 | |
| B. | 将烧杯中未冷却的NaOH溶液直接注入未经干燥的容量瓶中 | |
| C. | 定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切 | |
| D. | 将称好的NaOH固体放入烧杯中,加入适量水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
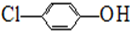 ),其原理如图1所示.
),其原理如图1所示.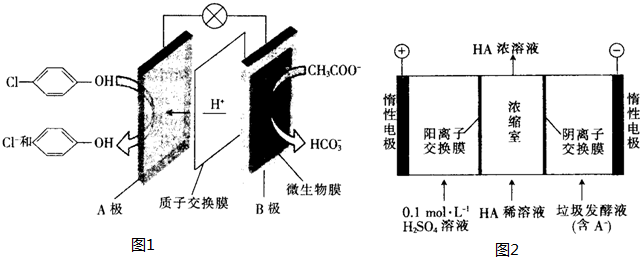
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 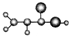 ①由C、H、O三种元素组成 ②球棍模型为: ③能与NH3在一定条件下反应生成丙烯酰胺CH2=CHCONH2 ④相对分子质量为72 |
| B | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与A反应生成相对分子质量为100的酯 |
| C | ①相对分子质量与B相同 ②能被新制的氢氧化铜悬浊液氧化 ③能与NaHCO3溶液反应放出CO2气体 |
| D | ①能使溴的四氯化碳溶液褪色 ②能与水在一定条件下反应生成B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广垃圾分类存放,分类回收,分类处理 | |
| B. | 改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的做法,采用先开采和综合利用煤层气,然后再采煤的方法 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 将工厂的烟囱造高,以减少工厂周围的大气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com