
下列关于电解质溶液的叙述正确的是 ( )。
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
A
【解析】选项A,Na2CO3的水解能力大于NaHCO3的水解能力,常温下,同浓度的Na2CO3溶液的pH大于NaHCO3溶液的。选项B,根据电荷守恒可得c(NH4+)+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(NH4+)=c(Cl-),故有c(NH4+)=c(Cl-)>c(H+)=c(OH-)。选项C,pH相同的盐酸、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和等体积、等pH的盐酸、CH3COOH溶液时,CH3COOH消耗NaOH的物质的量多。选项D,稀释盐酸时,c(H+)下降,但c(OH-)上升。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:2014年高二人教版化学选修五 1-1有机化合物的分类练习卷(解析版) 题型:选择题
下列有机物中,不属于烃的衍生物的是( )
A.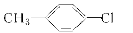
B.CH3CH2NO2
C.CH2=CHBr
D.?CH2—CH2?
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列有关分类的观点正确的是( )。
①由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应
②铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
③碳素钢、不锈钢和目前流通的硬币都属于合金
④生物质能、沼气和乙醇都是可再生能源
⑤氨水、醋酸、氢氧化铝都属于弱电解质
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:选择题
下列说法正确的是 ( )。
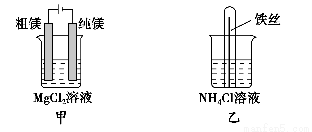
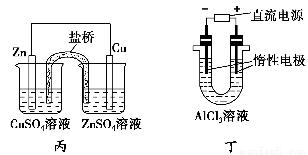
A.用甲装置电解精炼镁
B.用乙装置验证试管中铁丝发生析氢腐蚀
C.用丙装置构成铜锌原电池
D.用丁装置利用电冶金法制铝
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-??H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
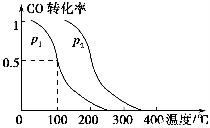
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g)??CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是___________________________________________。此时刻v正________v逆(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
A.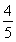 v(NH3)=v(O2)
v(NH3)=v(O2)
B.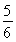 v(O2)=v(H2O)
v(O2)=v(H2O)
C.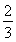 v(NH3)=v(H2O)
v(NH3)=v(H2O)
D.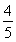 v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:选择题
下列有关原子结构及元素周期律的叙述正确的是 ( )。
A.同主族元素的原子最外层电子数相同,化学性质也相同
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题14物质结构与性质选考练习卷(解析版) 题型:填空题
钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是__________________________。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式):________________。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为________、________。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为________,每个K+与________个F-配位。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com