
【题目】将Na、Na2O,Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O,Na2O2的物质的量之比为( )
A.4:3:2
B.1:2:1
C.2:1:1
D.1:1:1
【答案】AC
【解析】解:Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比,直接核对选项即可得答案.(针对选择题)
钠与水、过氧化钠与水、氢气与氧气的反应方程式如下:
2Na+2H2O=2NaOH+H2↑ 钠与氢气的关系式为2Na﹣﹣H2
2Na2O2+2H2O=4NaOH+O2↑ 过氧化钠与氧气的关系式为 2Na2O2﹣﹣O2
2H2+O2 ![]() 2H2O 氢气和氧气的关系式为2H2﹣﹣O2
2H2O 氢气和氧气的关系式为2H2﹣﹣O2
将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,
通过钠与氢气、过氧化钠与氧气、氢气与氧气的关系式可得钠与过氧化钠的关系式为:4Na﹣﹣2H2﹣﹣O2﹣﹣2Na2O2
所以钠与过氧化钠的物质的量之比为4:2,满足条件的为AC,
故选AC.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2 , 其中X,Y,Z为金属元素,Z的最外层电子数与次外层电子数相等,X,Z位于同族,Y,Z,R,T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物的碱性:X>Z
D.XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列说法错误的是
A. 做油条用的膨松剂不应含明矾
B. 享有“镇国之宝”称谓的“后母戊鼎”属于青铜制品
C. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D. “煤改气”可以减少SO2等有害物质的排放量,有利于“雾霾”天气的治理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿司匹林在临床上的应用,下列说法正确的是
A. 阿司匹林有消炎的作用
B. 服用阿司匹林后出现胃肠道反应是中毒的表现,应立即停药
C. 阿司匹林有治疗癌症的作用
D. 服用阿司匹林中毒后应立即停药,并静脉滴注NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入CO2和CO物质的量之比为1:1的混合气体,这时测得容器内的压强为P1 , 若控制容器的体积不变,加入足量的Na2O2 , 充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2 , 则P1和P2之间的关系是( )
A.P1=P2
B.P1=2P2
C.P1=4P2
D.P1=8P2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界氮的循环过程如图.回答下列问题。

(1)上图中包含了_____种氮的固定方式,写出属于雷电作用固氮的化学方程式________。
(2)合成氮反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是______。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
(3)氮的循环中,亚硝酸盐是重要的一环,利用化合价可推知亚硝酸盐具有_____性和_____性,亚硝酸盐和酸性高锰酸钾反应的离子方程式为__________________。
(4)某同学加热Fe(NO3)2时,发现得到了红色固体和红色气体,且所得气体被水充分吸收后体积少于原体积的l/3,Fe(NO3)2热分解的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中所描述的物质一定是金属元素的是( )
A. 易失去电子的物质
B. 原子最外电子层只有一个电子的元素
C. 单质具有金属光泽的元素
D. 原子的最外电子层只有2个电子且核外电子总数大于3的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为__________________。
利用反应6NO2+8NH3 ![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________ L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________ L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=﹣196.6 kJ·mol-1
2SO3(g) ΔH=﹣196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=﹣113.0 kJ·mol-1
2NO2(g) ΔH=﹣113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于一恒容密闭绝热容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJ·mol-1。
CH3OH(g) ΔH=﹣a kJ·mol-1。
在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为_____,正反应放出的热量为__________________。
(4)已知N2O4(g) ![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是________。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是________。

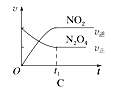

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com