
分析 (1)在体积不变的某密闭容器中加入NH4I,在某温度下,发生以下反应:设碘化铵分解生成氨气为x,生成HI为y,氨气分解生成氮气y,碘化氢分解生成氢气z
NH4I(s)?NH3(g)+HI(g)
x y
2NH3(g)?N2(g)+3H2(g)
x 0 0
x-2y y 3y
2HI(g)?H2(g)+I2(g)
y 0 0
y-2z z z
依据上述定量关系得到c(N2)、c(H2)、c(I2)之间的关系式;
(2)依据碘化铵中氮元素和碘元素守恒列出关系式;
(3)NH4I固体对化学平衡无影响;
解答 解:(1)在体积不变的某密闭容器中加入NH4I,在某温度下,发生以下反应:设碘化铵分解生成氨气为x,生成HI为y,氨气分解生成氮气y,碘化氢分解生成氢气z
NH4I(s)?NH3(g)+HI(g)
x y
2NH3(g)?N2(g)+3H2(g)
x 0 0
x-2y y 3y
2HI(g)?H2(g)+I2(g)
y 0 0
y-2z z z
依据上述定量关系得到c(N2)、c(H2)、c(I2)之间的关系式,c(H2)=3y+z=3c(N2)+c(I2),
故答案为:c(H2)=3c(N2)+c(I2);
(2)依据碘化铵中氮元素和碘元素守恒列出关系式,平衡状态下存在的微粒为;NH3 (g)、HI(g)、H2(g)、I2(g)、N2(g)
依据氮元素和碘元素守恒得到c(NH3)、c(HI)、c(N2)、c(I2)之间的关系式为:c(NH3)+2c(N2)=c(HI)+2c(I2),
故答案为:c(NH3)+2c(N2)=c(HI)+2c(I2);
(3)NH4I为固体,固体对化学平衡无影响,所以向平衡体系内加入少量NH4I固体,再次达到平衡后,容器中气体的颜色将不变,
故答案为:不变;
点评 本题考查了化学平衡的建立过程,原子守恒的理解应用,注意影响化学平衡的因素分析判断,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.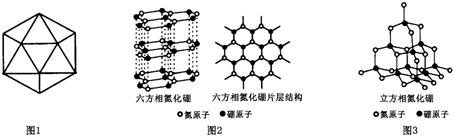
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 微粒 | EO2- | EO3- |
| 立体构型名称 |
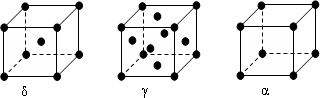
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾的一种重要因素 | |
| B. | 食品中的抗氧化剂本身是难于氧化的物质 | |
| C. | 含SO42-的澄清溶液中不会含Ba2+ | |
| D. | 凡溶于水能电离出H+离子的化合物均属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
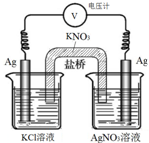 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag+(aq)+Cl-(aq)?AgCl(s) | D. | 盐桥中的K+向右池方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com