

 ,B
,B ,A为
,A为 ,然后结合有机物结构与性质来解答.
,然后结合有机物结构与性质来解答. ,B
,B ,A为
,A为 ,
, ,故答案为:
,故答案为: ;
;| 浓H2SO4 |
| △ |
 ,C+F→G的反应为CH3OH+HCOOH
,C+F→G的反应为CH3OH+HCOOH| 浓H2SO4 |
| △ |
 ;CH3OH+HCOOH
;CH3OH+HCOOH| 浓H2SO4 |
| △ |


科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
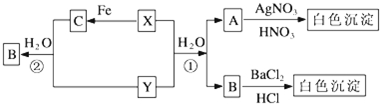
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol?L-1 NaOH | 50mL 0.5mol?L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL 0.55mol?L-1 NaOH | 50mL 0.5mol?L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水应密闭保存,放置低温处 |
| B、在FeCl2溶液中加入铁粉防止氧化变质 |
| C、常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5 |
| D、.实验室可用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com