
人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示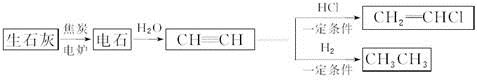
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)乙炔、乙烷分子中的碳原子杂化类型分别为________________、______________,甲烷的空间构型是________________,该空间构型中,键角__________(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有________个钙离子,研究表明,亚玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。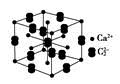
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)写出下列溶液中溶质的化学式
A___________,C_______________,E______________,F_________________。
(2)E的浓溶液与Cu应的化学方程式是______________________________________________________;该反应中氧化剂与还原剂的物质的量之比为____________;该反应的还原产物与少量B溶液反应的离子方程式是_____________________________________________________________________________。
(3)如何通过实验进一步确定D溶液的溶质?写出简要的操作及现象_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。请回答下列问题:
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式 。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为 ,SO2—4的立体构型是 ,其中S原子的杂化轨道类型是 。
(3)N、O、F三种元素的电负性由大到小的顺序为 ,Cu2O的熔点高于Cu2S,请解释原因: 。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为 。
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为 [列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6]。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前。“毒大米”是由镉污染引起的,会对人体健康造成严重危害。镉元素在元素周期表中的图示如图所示。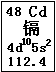
请回答下列问题:
(1)镉元素的原子序数为 ,在元素周期表中的位置是 。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论? 。
(3)你认为“毒大米”中镉的来源是什么? 。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O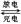 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
电池的负极是 。
负极的电极反应式为 。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA= 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: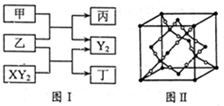
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中, 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”而独享2011年诺贝尔化学奖以及奖金。现在,准晶体已在很多应用领域“大展拳脚”,可用来制造不粘锅、发光二极管、热电转化设备等。
(1)铁在周期表中的位置 ,铝的原子结构示意图为 ;
(2)工业炼铝用的原料是 (填Al2O3或AlCl3),不用另一种的原因是
;
(3)铜在潮湿的空气中会生成铜绿,写出该反应方程式
;
(4)用电解法制Fe(OH)2沉淀,下列可做电解质溶液的是
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是 。B的氢化物与E的氢化物比较,沸点较高的是 (填化学式),在水中溶解度较大的是 (填化学式)
(2)写出D3B与甲反应所得溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用化学方程式表示) 。
(3)写出丙的电子式为 。说明丙的水溶液在放置过程中其酸性会增强的原因(用离子方程式表示) 。
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。可用来鉴别丁和氯化钠的试剂有
A.氢碘酸和淀粉的混合液 B.AgNO3溶液
C.甲基橙试剂 D.稀硫酸
(5)将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.化学反应中一定有化学键断裂,同时也有化学键形成 |
| B.含有共价键的化合物必是共价化合物 |
| C.含有阴离子的化合物一定含有阳离子 |
| D.金属元素和非金属元素形成的化合物不一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com