
分析 (1)设物质的量均为1mol,结合分子构成、N=nNA计算;
(2)SO2和SO3的氧原子个数比为1:1时,SO2和SO3的物质的量比为3:2,结合m=nM及分子构成计算.
解答 解:(1)设物质的量均为1mol,由分子构成、N=nNA可知,氧原子的个数比为1mol×2:1mol×3=2:3,
故答案为:2:3;
(2)SO2和SO3的氧原子个数比为1:1时,SO2和SO3的物质的量比为3:2,质量比为3×64:2×80=6:5,原子个数比为3×3:2×4=9:8,
故答案为:3:2;6:5;9:8.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系、分子构成为解答的关键,侧重分析与计算能力的考查,注意分子构成的应用,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有③ | C. | ①②③的混合物 | D. | ①②③④的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在此过程中,NO2是催化剂 | |
| B. | 该过程总反应的化学方程式为2O3═3O2 | |
| C. | 在此过程中,NO是反应的中间产物 | |
| D. | 光化学烟雾能引起人严重的呼吸功能障碍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2nA | |
| B. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9nA | |
| C. | 标准状况下,22.4L盐酸含有nA个HCl分子 | |
| D. | 1L1mol•L-1的NaClO 溶液中含有ClO-的数目为nA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,42 g乙烯和丁烯的混合气体中含有的碳原子数为3×6.02×1023 | |
| B. | 1mol碳正离子(CH5+)中含电子数为10×6.02×1023 | |
| C. | 1mol Cu和足量浓硝酸反应产生 2×6.02×1023个NO2分子 | |
| D. | 30 g乙烷中所含极性共价键数目为7×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
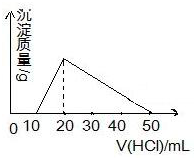 向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )| A. | 0.25mol/L | B. | 2mol/L | C. | 1mol/L | D. | 0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用灼烧法鉴别毛织品和棉织品 | |
| B. | 用纯碱洗涤锅盖上的油渍 | |
| C. | 用将铁屑、溴水、苯混合制溴苯 | |
| D. | 用淀粉溶液鉴别加碘食盐和不含碘的食盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com