
下列描述违背化学原理的是( )
A.NaHCO3溶液与NaAlO2 溶液混合产生白色沉淀,说明结合H+的能力:AlO
溶液混合产生白色沉淀,说明结合H+的能力:AlO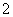 >CO
>CO
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,不能说明SO2具有漂白性
C.高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强
D.亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应
科目:高中化学 来源: 题型:
下列说法正确的是
A.石油裂解的目的是为了提高汽油等轻质油的产量和质量
B.等质量的葡萄糖和淀粉燃烧消耗的氧气量相等
C.用溴水可鉴别乙醇、环已烯和甲苯
D.分别用乙烷和乙烯制备氯乙烷的反应类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
用括号中注明的方法分离下列各组混合物,其中不正确的是 ( )
A.氮气和氧气(液化蒸馏) B.食盐中的沙砾(溶解过滤)
C.氢氧化铁胶体和水(过滤) D.花生油和水(分液)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是( )
A.向漂白粉浊液中通入过量CO2
B.向带有氧化膜的铝片中加入盐酸
C.向含1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
D.向含1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究苯与溴的取代反应,甲用下图装置Ⅰ进行如下实验:
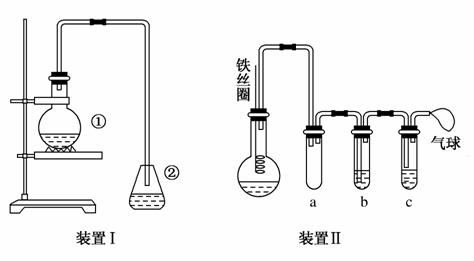
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3~5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置Ⅰ中①的化学方程式为________________。②中离子方程式为__________________________。
(2)①中长导管的作用是________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是________,要想得到纯净的产物,可用NaOH溶液试剂洗涤。洗涤后分离粗产品应使用的仪器是________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物。原因是____________________________________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是_____________。b中的试剂是_____________。
比较两套装置,装置Ⅱ的主要优点是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应A+3B===2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·s-1;
②v(B)=0.6 mol·L-1·s-1;
③v(C)=0.4 mol·L-1·s-1;
④v(D)=0.45 mol·L-1·s-1。
该反应进行的快慢顺序为________________。
(2)在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别为:v1、v2、v3(mol·L-1·s-1),且v1、v2、v3之间有如下关系:v2=3v1,v3=2v1,则此反应可表示为______________________。
(3)下列各项可以证明2HI(g)H2(g)+I2(g)已经达到平衡状态的是________。
①单位时间内生成n mol I2的同时生成n mol HI;
②一个H—H键断裂的同时有两个H—I键断裂;
③百分组成ω(HI)=ω(H2)时;
④反应速率v(H2)=v(I2)=v(HI)/2时;
⑤c(H2):c(I2) :c(HI)=1:1:2时;
⑥温度和体积一定,容器内压强不再变化时;
⑦温度和压强一定,混合气体的密度不再变化时;
⑧温度和体积一定,混合气体的颜色不再变化时。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com