
下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象与结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol·L-1 H2SO4溶液 | 试管口出现红棕色气体。则溶液中NO3-被Fe2+还原为NO2 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀。说明样品溶液中一定含有SO42- |
| C | 向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 | 红色加深。说明盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成。表明淀粉没有水解生成葡萄糖 |
BC
解析试题分析:硝酸盐在稀硫酸中具有强氧化性,将亚铁离子氧化为铁离子,稀硝酸被还原为无色的NO气体,而非红棕色的NO2,因为NO2易溶于水,并与水反应生成硝酸和NO,,NO被试管口空气中的氧气氧化为NO2,即3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O、2NO+O2=2NO2,故A错误;向样品溶液中先滴加过量稀盐酸无现象,再滴加少量BaCl2溶液,产生白色沉淀,说明样品溶液中一定含有硫酸根离子,这是检验硫酸根离子的合理方安,故B正确;碳酸钠是盐,使酚酞变红的溶液显碱性,说明碳酸钠与水发生水解反应,微热可使溶液红色加深,说明促进碳酸钠水解,由于升高温度平衡向吸热方向移动,则碳酸水解是吸热反应,故C正确;稀硫酸是淀粉水解的催化剂,催化剂在反应前后的质量、性质不变,则淀粉水解液呈酸性,由于葡萄糖与新制氢氧化铜悬浊液在碱性条件下加热,才能产生砖红色沉淀,在酸性条件下则不可能产生砖红色沉淀,所以加入氢氧化铜之前必须用NaOH中和硫酸至溶液呈碱性,故D错误。
考点:考查化学实验方案的设计与评价,涉及硝酸亚铁与稀硫酸反应的原理及现象、硫酸根离子的检验、盐类水解、淀粉是否水解等。


科目:高中化学 来源: 题型:单选题
下列实验操作不能达到其对应目的的是
| 序号 | 实验内容 | 实验目的 |
| A. | 向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀 |
| B. | 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C. | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
| D. | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热 | 验证淀粉已水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各图示实验操作合理的是( ) 
| A.图1为证明非金属性强弱:S>C>Si |
| B.图2为制备少量氧气 |
| C.图3为配制一定物质的量浓度的硫酸溶液 |
| D.图4为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案不可行或结论不正确的是
① 用酸性高锰酸钾溶液除去乙烷气体中的少量乙烯
② 将溴乙烷和NaOH溶液混合加热后,再加入硝酸银溶液,检验溴元素
③ 分液时,分液漏斗里下层液体从下口放出,上层液体从上口倒出
④ 向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉至完全反应,通过比较产生H2的体积判断两种酸的电离程度:醋酸<盐酸
⑤ 向新制的AgCl乳白色悬浊液中滴加0.1 mol/L的KI溶液,产生黄色沉淀,证明:Ksp[AgCl]>Ksp[AgI]
| A.①② | B.①③⑤ | C.②④ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(双选)下列实验方法正确的是
| A.用无水乙醇提取碘水中的碘单质 |
| B.加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42- |
| C.可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液 |
| D.玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备流程如下: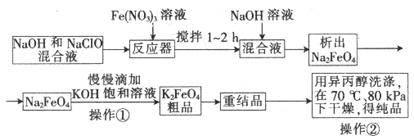
试回答下列问题
(1)反应器中,NaOH、NaClO、Fe(NO3)3发生反应生成Na2FeO4,完成并配平下列离子反应方程式:
□Fe3++□ClO─+□OH─ ==□FeO42─+□Cl─+□___________
(2)次氯酸钠浓度对高铁酸钾产率有一定影响,当NaClO浓度为298g/L时,高铁酸钠的产率最高,此时NaClO的物质的量浓度为_______________。
(3)你认为操作①能够发生转化的原因是__________,慢慢滴加的原因的是___________。
(4)操作②如果温度过高会造成高铁酸钾的分解,高铁酸钾受热分解时生成金属氧化物和氧气,该反应的化学方程式为__________________。
(5)可以用电化学法制取Na2FeO4,其装置如图所示,则阳极的电极反应式为 ;
阴极的电极反应式为______________;电解一段时间后溶OH─的浓度会_________(填“升高”、“降低”
或“不变”)。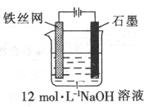
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com