
菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
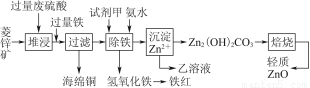
请结合下表数据,回答问题:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.3 | 9.7 |
Fe3+ | 1.5 | 3.2 |
Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
(1)C 2Fe2++H2O2+2H+=2Fe3++2H2O
(2)向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复上述操作2~3次 用试管取少量洗涤液,滴加氯化钡溶液,若有白色沉淀则表明未洗净,反之则表明已洗净
(3)3.2≤pH<6.2 bc
(4)1.2×10-3
【解析】(1)首先明确试剂甲的作用是将Fe2+转变为Fe3+,以便除去。双氧水无疑是最佳选择。
(3)调节pH时,应使Fe3+完全沉淀而Zn2+不生成沉淀,所以最适宜的pH范围是3.2~6.2。Fe3++3H2O??Fe(OH)3+3H+,加入ZnO能发生如下反应:ZnO+2H+=Zn2++H2O,且ZnO不溶于水,随着反应的进行,c(H+)减小,Fe3+的水解平衡右移,既除去了Fe3+又不引入新的杂质,加入Zn(OH)2可以达到相同的效果,不能加入Zn,因为它能与Fe3+反应,重新引入Fe2+,不能使用CuO,否则会生成Cu2+。(4)可根据溶度积的表达式计算溶液中离子浓度。c3(OH-)=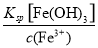 ,解得c(OH-)=1.0×10-7 mol·L-1,故c(Zn2+)=
,解得c(OH-)=1.0×10-7 mol·L-1,故c(Zn2+)=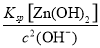 =1.2×10-3 mol·L-1。
=1.2×10-3 mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:简答题
菠萝酯是一种食用香料,是化合物甲与苯氧乙酸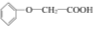 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是 。
(2)5.8 g甲完全燃烧产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 。
(3)苯氧乙酸有多种酯类的同分异构体,写出其中能与FeCl3溶液发生显色反应,且苯环上只有两种一硝基取代物的所有可能的同分异构体的结构简式:
。
(4)已知:
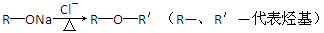
菠萝酯的合成路线如下:
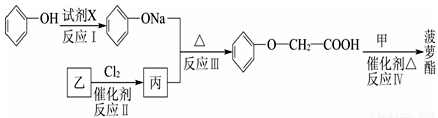
①试剂X不能选用的是(选填字母) 。
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na
②丙的结构简式是 ,反应Ⅱ的反应类型是 。
③反应Ⅳ的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题13化学实验基础练习卷(解析版) 题型:实验题
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为______________________________。
(2)这样制取的二氧化硫气体中可能含有的杂质是__________________;原因是________________________________________________________________________________________________________________________________________________。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________(用a、b……填写)。
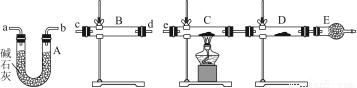
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
装置 | 所盛药品 | 实验现象 | 结论或解释 |
B |
|
|
|
C | CuO固体 |
|
|
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
分子式为C5H12O的醇与C5H10O2的酸发生酯化反应最多可形成多少种酯( )
A.8种 B.16种 C.24种 D.32种
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.1mol蔗糖可水解生成2 mol葡萄糖
B.CH3—CH=CH—CH3与C3H6一定互为同系物
C.CHCH3CH3CHCH3CH3的名称是2,3?甲基丁烷
D.乙醇可与水以任意比例混溶,是因为与水形成了氢键
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下不能实现的是( )

A.①②③ B.②③④ C.②③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是( )
A.炭具有强还原性,常用于冶炼镁、钠等金属
B.铝的金属性较强,可用作飞机、火箭的结构材料
C.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污
D.浓硫酸具有强氧化性,可用于与亚硫酸钠反应制取二氧化硫
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4??Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C.Na2Cr2O7中Cr元素的化合价为+7
D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:填空题
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
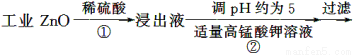
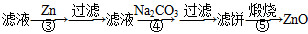
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com