
| A. | 蛋白质 | B. | 淀粉 | C. | 油脂 | D. | 纤维素 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 2KI+Br2═2KBr+I2 | B. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | ||
| C. | SO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$H2SO4 | D. | MgCl2+2NaOH $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
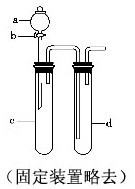 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量6mol•L-1的盐酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加入少量铜粉 | D. | 加入少量金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数为0.3 NA | |
| D. | 1 mol Na2O2与足量CO2反应转移的电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加铜片和浓硫酸,加热 | 有无色气体产生,遇空气变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有不溶于稀硝酸的白色沉淀生成 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
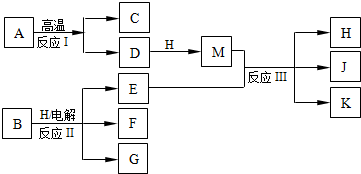
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com