
要证明氯乙烷中氯元素的存在可进行如下操作,其中顺序正确的是( )
①加入AgNO3溶液②加入NaOH溶液③加热④加入蒸馏水⑤加入HNO3酸化
A.②③⑤① B.④③⑤① C.④①⑤ D.②③①⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定条件下,C0与H2反应可生成乙醇:2CO+4H2 ⇌ CH3CH20H+H20。下列关于该反应的说法错误的是
A.增大CO的浓度能减小反应速率 B.升高体系温度能增大反应速率
C.使用合适的催化剂可增大反应速率
D.若反应在密闭容器中进行,H2和C0不能全部转化为产物
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
A.MgF2 B.MgCl2 C.CaCl2 D.CaBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
某甲酸溶液中含有甲醛,用下列方法可以证明的是
A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀
B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应
C.将试液进行酯化反应后的混合液能发生银镜反应
D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是 ( )
A.NaOH溶液 B.CH3COOH C.稀HNO3 D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
 ②有关有机物的沸点:
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是______________________。若反应前向D中加入几
(3)滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________;反应结束后D中的现象是__________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
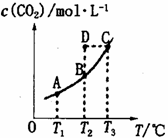 A.平衡状态A与C相比,平衡状态A的c(CO)小
A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.反应CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
△H>0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程。

已知1:物质的溶解度(g/100g水) 已知2:
| 物质 | 0℃ | 40℃ | 80℃ |
| KCl | 28.0 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38.0 |
| K2Cr2O7 | 4.7 | 26.3 | 73.0 |
| Na2Cr2O7 | 163.0 | 215.0 | 376.0 |
①焙烧时有Na2CrO4、 Fe2O3 、NaAlO2 等生成。
②Cr2O72- + H2O  2CrO42- + 2H+ ;
2CrO42- + 2H+ ;
Cr2O72-具有很强的氧化性
回答问题:
(1)“浸出”步骤中,为了提高浸出率,可采取的措施有 (要求写一条)。
(2)固体b中主要含有 (填写化学式)。
(3)要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或用品名称)。
(4)酸化步骤用醋酸调节溶液的pH﹤5,其目的是 ;
不用盐酸调节溶液pH的原因是 。
(5)操作III发生反应的化学方程式是 ,
要得到K2Cr2O7 晶体的操作步骤是蒸发浓缩、冷却结晶、 、 和干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com