
【题目】下列物质中导电性最差的是( )
A.0.6 mol·L1的硫酸
B.0.1 mol·L1的盐酸
C.熔融的NaCl
D.硝酸钾晶体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精。一种制备方法如图所示,下列说法正确的是
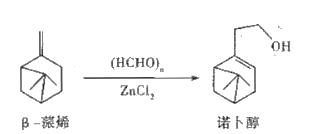
A. 可用溴的CCl4溶液区别β-蒎烯与诺卜醇
B. β-蒎烯的饱和碳原子上的一氯代物最多有7种
C. β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D. 可用乙酸检验β-蒎烯是否含有诺卜醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,浓度均为1mol/L的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。下列叙述错误的是
已知:①HA的电离平衡常数:![]()
②pKa=-lgKa
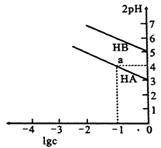
A. 酸性:HA>HB
B. a点对应的溶液中:c(HA)=0.1mol/L,c(H+)=0.01mol/L
C. T℃时,弱酸HB的pKa≈5
D. 弱酸的Ka随溶液浓度的降低而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的相对分子质量为84,分子中含有碳碳双键,且分子中只有一种类型的氢。
(1)A的结构简式为____________________。
(2)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。

C的化学名称是_______________;E2的结构简式是_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1、以物质的量为中心的计算:
(1)VL Al2(SO4)3溶液中含有Al3+m g,则SO42-的物质的量浓度为____________。
(2)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(3)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
2、将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu=2FeCl2+CuCl2。
(1)请用双线桥法标出电子转移的方向和数目______________________。
(2)该反应中氧化剂是_______________,发生氧化反应的物质是_______________。
(3)当有0.4 mol电子发生转移时,发生反应的Cu的质量为____________。
(4)当有1 mol FeCl3完全反应时,转移的电子数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是燃料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和固定仪器的装置略去)。回答下列问题:
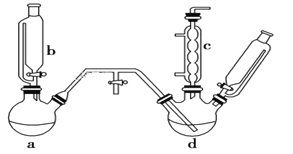
(1)a和b仪器组合成制取氯气的装置,反应无需加热,则a装置中的固体反应物可以是________(填字母序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)把氯气通入反应器d中(d装置有FeCl3和苯),加热维持反应温度40~60 ℃,温度过高会生成过多的二氯苯。对d加热的方法是______________________。
(3)装置c出口的气体成分有HCl、Cl2、水蒸气和_____。
(4)制取氯苯的化学方程式为_______________________ 。
(5)装置d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。
①碱洗之前要水洗,其目的是______________________________。
②用10%NaOH溶液碱洗时发生氧化还原反应的化学反应方程式为_____________________。
(6)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸气,请画出该装置图,并标明所用试剂________。
(7)工业生产中苯的流失情况如下表所示:
项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
苯流失量kg/t | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
则10t苯可制得成品氯苯________t(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氮和肼(N2H4)是两种最常见的氮氢化物。
已知:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是______(填字母代号)。
A.c(CO)=c(CO2)
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
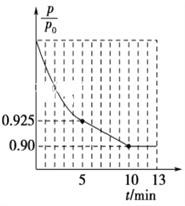
②图1为容器内的压强(p)与起始压强(p0)的比值![]() 随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
(3)使用间接电化学法可处理燃烧烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________________。用离子方程式表示吸收池中除去NO的原理____________________________________________。
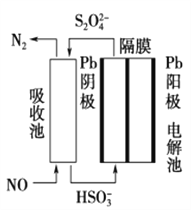
【答案】 4NH3(g)+O2(g)2N2H4(g)+2H2O(g)ΔH=+526.2 kJ·mol-1 K1/K22 D 0.006 mol·L-1·min-1 80% 2HSO3-+2e-+2H+===S2O42-+2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
【解析】(1)①4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=![]() ,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol;
,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol; ![]() ;
;
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①A.c(CO)=c(CO2),不表示浓度变化,不能判断是否为平衡状态,故A错误;B.反应中气体的质量不变,体积不变,容器中混合气体的密度始终不变,不能判断是否为平衡状态,故B错误;C.v(N2)正=2v(NO)逆表示,应该是2v(N2)正=v(NO)逆,才表示正逆反应速率相等,故C错误;D.该反应属于气体的物质的量发生变化的反应,容器中混合气体的平均摩尔质量不变时表示气体的物质的量不变, 说明是平衡状态,故D正确;故选D;
②根据容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线,0~5min内,![]() =0.925,根据阿伏伽德罗定律及其推论,
=0.925,根据阿伏伽德罗定律及其推论,![]() =0.925,平衡时
=0.925,平衡时![]() =0.90,
=0.90,
2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 0.1 0.3 0 0
反应 2x 2x x 2x
5min及平衡 0.1-2x 0.3-2x x 2x
5min时,![]() =0.925,解得x=0.03mol,v(N2)=
=0.925,解得x=0.03mol,v(N2)=![]() = 0.006mol·L-1·min-1;平衡时,
= 0.006mol·L-1·min-1;平衡时,![]() =0.90,解得x=0.04mol,NO的转化率=
=0.90,解得x=0.04mol,NO的转化率=![]() ×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O═N2+4HSO3-;故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-。
【题型】填空题
【结束】
10
【题目】锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:
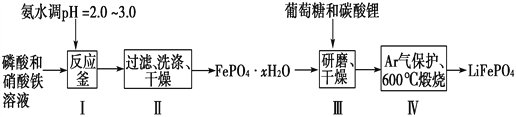
已知:Ksp(FePO4·xH2O)=1.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的________等离子。
(3)取3组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 | 1 | 2 | 3 |
固体失重质量分数 | 19.9% | 20.1% | 20.0% |
固体失重质量分数=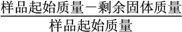 ×100%,则x=_______(精确至0.1)。
×100%,则x=_______(精确至0.1)。
(4)步骤Ⅲ中研磨的作用是__________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________。
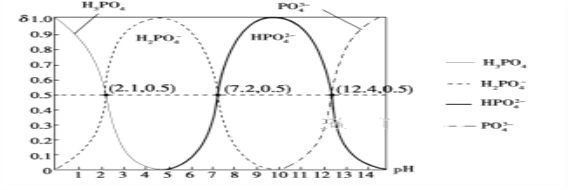
(6)H3PO4是三元酸,如图是常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO![]() 第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com